Iot là nguyên tố vi lượng vô cùng cần thiết cho dinh dưỡng của loài người. Thực tế, tại những vùng đất xa biển hoặc thiếu thức ăn trên thế giới, tình trạng thiếu iod có thể xảy ra và gây nên bệnh bướu cổ hay thiểu năng trí tuệ. Vậy iot là gì? Cùng tìm hiểu tính chất và những ứng dụng phổ biến nhất của iot trong bài viết này.
.jpg)
Muối iot là gì?
Có nguồn gốc từ tiếng Hy Lạp, Iot là một nguyên tố hoá học có tên gọi chính thức theo Hiệp hội Quốc tế về Hóa Lý thuyết. Trong bảng tuần hoàn, iot có ký hiệu là I và số nguyên tử là 53.
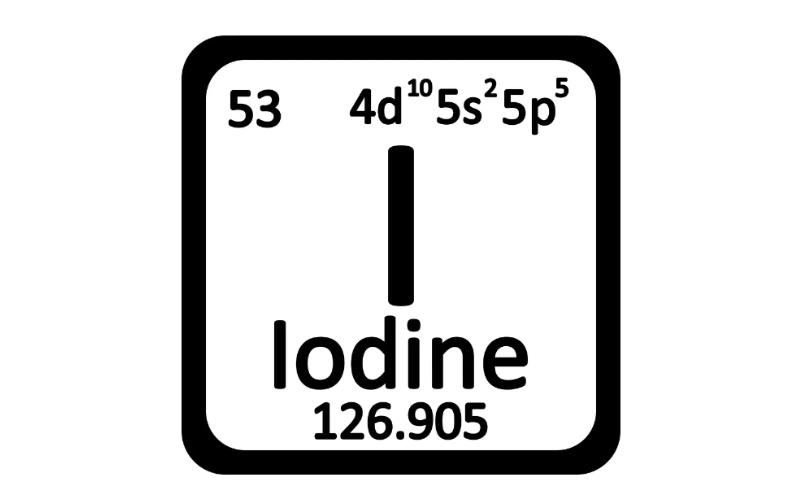
Iot là một trong các nguyên tố vi lượng cần thiết cho sự sống của nhiều sinh vật trên trái đất trong đó có con người. Về mặt hoá học, iot ít hoạt động nhất và có độ âm điện thấp nhất trong tất cả các halogen. Giống như các halogen khác (thuộc nhóm nguyên tố VII trong bảng tuần hoàn), iot thường có mặt ở dạng phân tử hai nguyên tử, I2.
Muối iot là thuật ngữ quen thuộc mà chúng ta sử dụng hàng ngày – một loại muối ăn có bổ sung thêm lượng nhỏ NaI nhằm cung cấp iot cho cơ thể. Trên thế giới, có khoảng 2 tỷ người thiếu iod và đây là nguyên nhân có thể phòng ngừa hàng đầu của thiếu năng trí tuệ và bướu cổ. .
Trạng thái tự nhiên và tính chất vật lý của iot
Iot được tìm thấy ở đâu, iot màu gì, iot có tan trong nước không, và chúng những tính chất vật lý là gì? Chúng ta sẽ tìm hiểu ở phần này.

Trạng thái tự nhiên
So với các halogen khác, iot có rất ít trong vỏ trái đất.
-
Nước biển: Trong tự nhiên, iot được tìm thấy ở dạng hợp chất, chủ yếu là các muối natri và kali của chúng và có trong nước biển.
-
Rong biển: Một số hợp chất của iot còn gặp trong vài loài rong biển.
-
Tuyến giáp: Iot còn xuất hiện trong tuyến giáp của con người, hàm lượng này tuy nhỏ nhưng vô cùng quan trọng. Nếu thiếu iot này, con người sẽ bị bệnh bướu cổ.
-
Iot có tới 37 đồng vị, tuy nhiên chỉ có 127I là bền vững.
Tính chất vật lý
Màu sắc: Iot là chất rắn có màu xám sáng – vẻ sáng đặc trưng giống kim loại.
Hiện tượng thăng hoa:
-
Khi được đun nóng, iot không nóng chảy mà chuyển thành thể hơi màu tím.
-
Khi được làm lạnh, hơi iot lại chuyển thành dạng tinh thể, không qua trạng thái lỏng.
Khả năng hòa tan:
-
Iot ít tan trong nước nhưng tan nhiều trong các dung môi hữu cơ như xăng, benzen, rượu…. Dung dịch của iot trong nước được gọi là nước iot.
Tính chất hóa học của iot
Iot là một chất oxi hoá mạnh, nhưng oxi hóa kém clo và brom. Để tìm hiểu kĩ hơn về tính chất hóa học của iot, chúng ta cùng theo dõi phản ứng của iot khi tác dụng với kim loại, với hidro, clo và brom.

Tác dụng với kim loại
Iot oxi hóa được nhiều kim loại nhưng chỉ xảy ra với điều kiện có chất xúc tác hoặc được đun nóng.
Ví dụ: 2Al + 3I2 → 2AlI3
Tác dụng với hidro
Iot hầu như không tác dụng với nước. Iod có thể oxi hoá H2 ở nhiệt độ cao khi có chất xúc tác. Phản ứng này tạo ra khí Hiđro iotua không bền theo một phản ứng thuận nghịch:
H2 +I2 → 2HI (mũi tên 2 chiều)
2HI → H2 +I2 (mũi tên 2 chiều)
Hidro Iotua dễ tan trong nước tạo thành dung dịch axit Iothidric, đó là 1 axit rất mạnh, mạnh hơn cả axit clohidric, bromhidric: HF < HCl < HBr < HI
Oxi hóa kém clo và brom
Oxi hóa kém clo và brom là một trong những tính chất hóa học đặc trưng của iot.
Cl2 + 2NaI → 2NaCl + I2
Br2 + 2NaI → 2NaBr + I2
Tính khử của axit HI
HI là một axit có tính khử mạnh. Nó có thể khử được axit H2SO4 đặc.
8HI + H2SO4 → 4I2 + H2S + 4H2O
2HI + 2FeCl3 → FeCl2 + I2 + 2HCl
Điều chế iot như thế nào?
Iot được điều chế như thế nào?
-
Trong công nghiệp, người ta sản xuất iot từ rong biển. Bên cạnh đó, iot có thể thu được ở tinh khiết nhất bằng phản ứng giữa KI với sunfat đồng (II).
-
Cũng có một vài cách khác để tách iot. Mặc dù khá hiếm gặp, nhưng tảo bẹ cùng một số loài cây khác có khả năng hấp thụ và tập trung iot trong cơ thể, quá trình này giúp mang iốt vào dây chuyền thức ăn tự nhiên và khiến việc điều chế iot có giá thành thấp.
-
Người ta cho dung dịch phản ứng với chất oxi hoá để oxi hoá I- thành I2:
2NaI + Cl2 -> 2NaCl + I2
Ứng dụng của iot trong đời sống
Phần lớn, iot được ứng dụng để sản xuất ra nhiều loại dược phẩm khác nhau, điển hình như:

-
Chất sát trùng: Được ứng dụng nhiều trong sản xuất cồn iot (dung dịch iot 5% trong ancol etylic) có tác dụng làm chất sát trùng, khử trùng vết thương, khử trùng bề mặt.
-
Muối iot: Iot được trộn với lượng nhỏ KI và KIO3 thành muối iot giúp phòng tránh các rối loạn do thiếu iot như bướu cổ.
-
Hợp chất iot thường được ứng dụng trong hóa hữu cơ và y khoa.
Ngoài ra, iot còn có những ứng dụng:
-
Ứng dụng trong nhiếp ảnh: Muối iodide bạc (AgI) được dùng trong nhiếp ảnh.
-
Sử dụng trong điều trị ung thư tuyến giáp: Iot-123 dùng trong y khoa để xét nghiệm hoạt động của tuyến giáp. Iot-131 dùng trong điều trị ung thư tuyến giáp và bệnh Grave.
-
Rửa trôi đồng vị phóng xạ: Muối iodide kali (KI) có thể dùng để chữa trị cho các bệnh nhân bị ảnh hưởng của thảm họa hạt nhân để rửa trôi đồng vị phóng xạ I-131…
Xem thêm:
- Nhóm halogen là gì? Vị trí, đặc điểm, tính chất, cấu hình electron
- Số oxi hóa là gì? 4 quy tắc xác định số oxi hóa của 1 nguyên tố
Bài tập về iot SGK hóa học 10 kèm lời giải chi tiết
Như vậy, chúng ta đã tìm hiểu những kiến thức cơ bản về iot, tính chất hóa học, vật lý, điều chế, ứng dụng của nguyên tố này. Cùng vận dụng những gì đã học ở những phần trên để thực hành một số bài tập Hóa học 10 về iot như sau:
Bài tập 5 Hoá 10 SGK trang 114
Muối NaCl có lẫn tạp chất là NaI.
a) Làm thế nào để chứng minh rằng trong muối NaCl nói trên có lẫn tạp chất NaI?.
b) Làm thế nào để có NaCl tinh khiết.
Lời giải:
a) Để chứng minh rằng trong muối NaCl có lẫn tạp chất NaI, người ta sục khí clo vào dung dịch muối NaCl có lẫn tạp chất NaI, nếu có kết tủa màu đen tím tác dụng với hồ tinh bột tạo thành hợp chất màu xanh thì chứng tỏ trong muối NaCl có lẫn tạp chất NaI.
b) Để thu được NaCl tinh khiết, người ta sục khí clo dư vào dung dịch NaCl có lẫn tạp chất NaI, lọc kết tủa (hoặc đun nóng iot rắn biến thành hơi) được NaCl tinh khiết trong dung dịch nước lọc.
Cl2 + 2NaI → 2NaCl + I2 (màu đen tím).
Giải Bài 10 Hoá 10 SGK trang 114
Làm thế nào để phân biệt dung dịch NaF và dung dịch NaCl?
Lời giải:
Cho dung dịch AgNO3 vào 2 mẫu thử chứa dung dịch NaF và dung dịch NaCl, mẫu thử nào có kết tủa trắng NaCl, mẫu thử còn lại không tác dụng là NaF.
AgNO3 + NaF → không phản ứng (AgF dễ tan trong nước).
AgNO3 + NaCl → AgCl↓ + NaNO3.
Trên đây là những lý thuyết cơ bản về iot mà các bạn sẽ được học trong môn Hóa học 10. Hy vọng rằng, thông qua bài viết này, các bạn đã có thể nắm chắc được những kiến thức cơ bản về iot và vận dụng hiệu trong các bài tập thực hành. Cảm ơn các bạn đã theo dõi bài viết, hãy chia sẻ nếu thấy có ích nhé!
