Rượu etylic (công thức hóa học C2H6O) thu được sau khi lên men gạo, sắn, ngô (đã nấu chín) hoặc quả nho, quả táo… Cùng tìm hiểu tính chất, cấu tạo phân tử, ứng dụng và cách điều chế của loại chất này.
Rượu etylic là gì?
-
Công thức phân tử: C2H6O
-
Phân tử khối: 46
-
Cấu tạo phân tử:
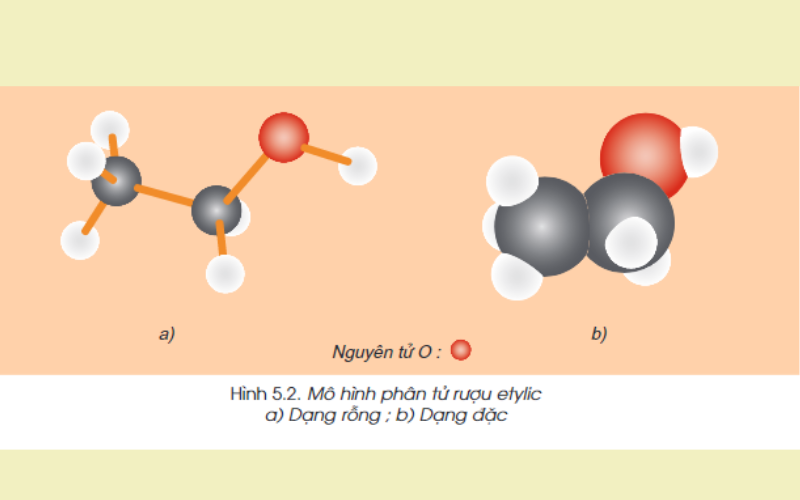
Công thức cấu tạo rút gọn: CH3-CH2-OH
Trong phân tử rượu Etylic có một nguyên tử H không liên kết với nguyên tử C mà liên kết với nguyên tử Oxi tạo ra nhóm – OH. Chính nhóm – OH này làm cho rượu mang những tính chất hóa học đặc trưng.
Tính chất vật lý của rượu etylic
Rượu etylic (C2H6O) mang những tính chất vật lý sau đây:
-
Rượu etylic là chất lỏng không màu, sôi ở 78,3 độ C, nhẹ hơn nước và tan vô hạn trong nước.
-
Rượu etylic hòa tan được nhiều chất như iot, benzen,…
-
Số ml rượu etylic có trong 100ml hỗn hợp rượu với nước gọi là độ rượu. Ví dụ, 100ml rượu 45 độ chứa 45ml rượu etylic nguyên chất.
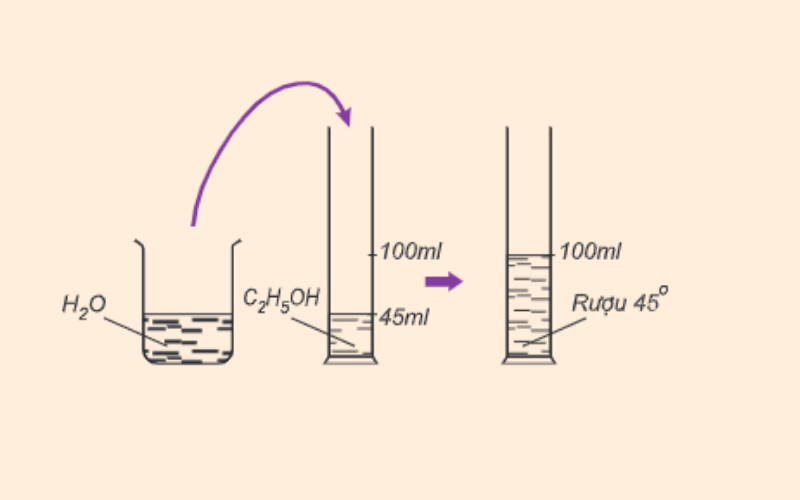
Công thức tính độ rượu như sau:
Độ rượu = Vr / Vhh x 100
Trong đó:
-
Đr là độ rượu (độ)
-
Vr là thể tích rượu etylic (ml)
-
Vhh là thể tích của hỗn hợp rượu và nước (ml)
Công thức tính độ rượu hoàn chỉnh là độ rượu = 100 %. Độ rượu càng lớn thì dung dịch rượu etylic càng chứa nhiều cồn và ngược lại.
Tính chất hóa học của rượu etylic
Với những đặc điểm liên kết trên, rượu etylic mang 3 tính chất hóa học đặc trưng được chứng minh bởi những thí nghiệm chi tiết sau:

Tác dụng mạnh với oxi khi đốt nóng
Ta thực hiện thí nghiệm nhỏ vài giọt rượu etylic vào chén sứ rồi đốt. Khi rượu Etylic bị đốt cháy, chúng ta sẽ thấy xuất hiện ngọn lửa màu xanh và tỏa nhiều nhiệt. Lúc này, rượu etylic tác dụng mạnh với oxi khi đốt nóng, tạo thành phản ứng cháy.
Phản ứng xảy ra theo phương trình sau:
C2H6O (l) + 3O2 (k) (nhiệt độ) → 2CO2 (k) + 3H2O (h)
Phản ứng với natri
Ta thực hiện thí nghiệm cho mẩu natri vào cốc (ống nghiệm) đựng rượu etylic. Quan sát thí nghiệm trên, ta thấy có bọt khí thoát ra, mẩu natri tan dần. Như vậy, tương tự nước, rượu etylic tác dụng được với natri, giải phóng khí hidro.
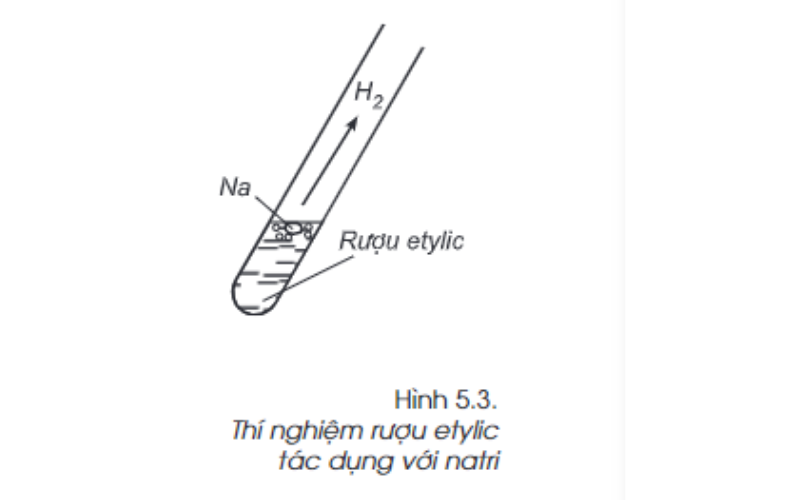
Phản ứng xảy ra như sau:
2C2H5OH (l) + 2Na (r) → 2C2H5ONa (dd) + H2 (k)
Loại rượu này có thể tạo ra phản ứng hóa học với các kim loại mạnh ví dụ như K hay Na.
Phản ứng với axit axetic
Ta thực hiện thí nghiệm cho rượu etylic, axit axetic vào ống nghiệm A. Thêm một ít axit sunfuric đặc làm xúc tác. Đun sôi hỗn hợp trong một thời gian, sau đó ngừng đun. Thêm một ít nước vào chất lỏng ngưng tụ trong ống nghiệm B, lắc nhẹ rồi quan sát.
Chúng ta sẽ quan sát thấy hiện tượng: Trong ống nghiệm B có chất lỏng không màu, mùi thơm, không tan trong nước, nổi trên mặt nước. Điều đó chứng minh rằng, rượu etylic tác dụng với axit axetic tạo ra etyl axetat. Đây là chất lỏng, mùi thơm, ít tan trong nước, dùng làm dung môi trong công nghiệp.
Phản ứng xảy ra như sau:
C2H5OH + CH3COOH ⇄ CH3COOC2H5 + H2O ( H2S04 đặc, nhiệt độ)
Hai cách điều chế rượu etylic
Tùy vào nhu cầu sử dụng của chúng ta, rượu etylic có 2 phương pháp điều chế như sau:

Phương pháp 1: Rượu etylic được điều chế rượu làm đồ uống
Để điều chế rượu làm đồ uống, người ta kết hợp tinh bột hoặc đường glucozo, xúc tác là men rượu để thu được rượu etylic theo phương trình sau:
Tinh bột/ đường (men) —> Rượu etylic
Phương pháp 2: Sản xuất rượu phục vụ ngành công nghiệp
Để điều chế rượu phục vụ ngành công nghiệp, người ta cho etilen cộng hợp với nước, với chất xúc tác là axit theo phương trình sau:
CH2 = CH2 + H2O (axit) → C2H5OH
Chú ý: Những hợp chất hữu cơ, phân tử có nhóm OH, có công thức phân tử chung là CnH2n+1OH gọi là ancol no đơn chức hay ankanol cũng có tính chất tương tự rượu etylic.
Ứng dụng rượu etylic
Rượu etylic ngoài ứng dụng phổ biến nhất là làm đồ uống, chúng cũng có thêm những ứng dụng quan trọng sau đây.
.jpg)
-
Là nguyên liệu để sản xuất dược phẩm, rượu bia, cao su tổng hợp, axit axetic.
-
Rượu etylic dùng làm dung môi để pha chế vecni, nước hoa.
-
Được sử dụng như là nhiên liệu cồn (thường được trộn lẫn với xăng) và trong hàng loạt các quy trình công nghiệp khác. Rượu etylic cũng còn có thể dùng trong các sản phẩm chống đông lạnh vì điểm đóng băng thấp đặc trưng.
-
Dung dịch chứa 70% rượu etylic dùng làm tẩy uế, các gel vệ sinh kháng khuẩn phổ biến nhất ở nồng độ 62%. Rượu etylic được sử dụng để khử trùng rất tốt khi sử dụng chất này ở dung dịch khoảng 70%, nồng độ cao hơn hay thấp hơn lại có khả năng kháng khuẩn kém hơn. Rượu etylic giết chết các sinh vật chủ yếu bằng cách biến tính protein và hòa tan lipit của chúng. Ngoài ra, nó còn có hiệu quả trong việc chống lại các loại vi khuẩn và nấm cùng với nhiều loại virus nhưng kém hiệu quả trong việc chống lại các bào tử vi khuẩn.
Bài tập về rượu etylic SGK Hóa học 9 kèm lời giải
Từ những kiến thức về rượu etylic (C2H6O) ở trên, các bạn cùng vận dụng những kiến thức đó để giải một số bài tập cơ bản trong SGK hóa học 9 sau.

Giải Bài 1 trang 139 SGK Hóa 9
Rượu etylic phản ứng được với natri vì:
A. Trong phân tử có nguyên tử oxi.
B. Trong phân tử có nguyên tử hidro và nguyên tử oxi.
C. Trong phân tử có nguyên tử cacbon, hidro và oxi.
D. Trong phân tử có nhóm – OH.
Gợi ý đáp án:
Đáp án: D. Câu A, B, C không chính xác.
Giải bài 2 Hoá 9 SGK trang 139
Trong số các chất sau: CH3 – CH3, CH3 – CH2OH, C6H6, CH3 – O – CH3 chất nào tác dụng được với Na? Viết phương trình hóa học.
Gợi ý đáp án:
2CH3CH2OH + 2Na → 2 CH3CH2ONa + H2↑
Giải bài 3 SGK Hóa 9 trang 139
Có ba ống nghiệm: Ống 1 đựng rượu etylic ống 2 đựng rượu 96o, ống 3 đựng nước. Cho Na dư vào các ống nghiệm trên, viết các phương trình hóa học.
Gợi ý đáp án:
Các phương trình phản ứng hóa học:
Ống 1: Rượu etylic tác dụng với Na
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2
Ống 2: Rượu 96o tác dụng với Na ⇒ gồm C2H5OH và H2O tác dụng với Na
2H2O + 2Na → 2NaOH + H2
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2
Ống 3: Nước tác dụng với Na
2H2O + 2Na → 2NaOH + H2
Giải Bài 4 trang 139 SGK Hóa 9
Trên các chai rượu đều có ghi các số, thí dụ 45 độ, 18 độ, 12 độ.
a) Hãy giải thích ý nghĩa của các số trên.
b) Tính số ml rượu etylic có trong 500ml chai rượu 45 độ.
c) Có thể pha được bao nhiêu lít rượu 25 độ từ 500ml rượu 45 độ.
Gợi ý đáp án:
a) Các con số 45 độ, 18 độ, 12 độ có nghĩa là trong 100ml có rượu 45ml, 18ml, 12ml rượu nguyên chất.
b) Số ml rượu etylic có trong 500ml rượu 45o là: (500 x 45)/100 = 225ml
c) 900ml = 0,9 lít
Theo câu b): Trong 500ml rượu 45o có 225ml rượu nguyên chất.
⇒ Số ml rượu 25o pha chế được từ 500ml rượu 45o (hay từ 225ml rượu nguyên chất) là: (225 x 100)/25 = 900ml
Một số bài tập về rượu Etylic để học sinh tự luyện
Ngoài bài tập trong sách giáo khoa, dưới đây là một số bài tập liên quan để học sinh tự luyện:
Câu 1: Để phân biệt hai chất lỏng nguyên chất, không màu là benzen và rượu etylic ta dùng kim loại nào sau đây?
A. sắt.
B. đồng
C. natri.
D. nhôm.
Câu 2: Cho 46 gam rượu etylic nguyên chất tác dụng với lượng dư kim loại K. Thể tích khí H2 thoát ra (ở đktc) là
A. 2,8 lít.
B. 5,6 lít.
C. 8,4 lít.
D. 11,2 lít.
Câu 3: Hòa tan 60 ml rượu etylic nguyên chất vào 90 ml nước cất thu được
A. rượu etylic có độ rượu là 200.
B. rượu etylic có độ rượu là 250.
C. rượu etylic có độ rượu là 300.
D. rượu etylic có độ rượu là 400.
Câu 4: Hợp chất hữu cơ A có công thức phân tử là C2H6O biết A phản ứng với Na giải phóng H2. Công thức cấu tạo của A là
A. CH3 – CH2 – OH.
B. CH3 – O – CH3.
C. CH3 – CH3 = O.
D. CH3 – OH – CH2.
Câu 5: Rượu etylic không thể tác dụng với chất nào sau đây?
A. H2 (xúc tác Ni, t0).
B. CH3COOH.
C. Na.
D. K.
Câu 6: Số ml rượu etylic có trong 250ml rượu 45 độ là
A.250ml
B.215ml
C.112,5ml
D. 275ml
Câu 7: Cho rượu etylic 700 tác dụng với lượng dư kim loại natri. Số phản ứng hóa học có thể xảy ra là
A. 1.
B. 3.
C. 2.
D. 4.
Câu 8: Hòa tan 40 ml rượu etylic nguyên chất vào 120 ml nước cất thu được
A. rượu etylic có độ rượu là 200.
B. rượu etylic có độ rượu là 250.
C. rượu etylic có độ rượu là 300.
D. rượu etylic có độ rượu là 350.
Câu 9:Đốt cháy hoàn toàn 50ml rượu etylic a độ thu được 22,4 lít khí CO2 ở đktc. (Biết khối lượng riêng của rượu là 0,8g/ml). Giá trị của a là
A. 57,5.
B. 60.
C. 62.
D. 70.
Câu 10: Cho 30 gam axit axetic tác dụng với rượu etylic dư tạo ra 27,5 gam etyl axetat. Hiệu suất của phản ứng là
A. 72,5%.
B. 62,5 %.
C. 56,2%.
D. 65,2 %.
Câu 11: Cho 13,6 gam hỗn hợp X gồm axit axetic và rượu etylic được trộn theo tỉ lệ mol tương ứng là 3 : 2. Đun nóng X với H2SO4 đặc một thời gian thu được m gam este CH3COOCH2CH3 với hiệu suất phản ứng là 90%. Giá trị của m là
A. 7,04g.
B. 8,80g.
C. 7,92g.
D. 11,00g.
Câu 12: Cho 18 gam một rượu X, thuộc cùng dãy đồng đẳng với rượu etylic (có công thức tổng quát CnH2n+1OH) tác dụng với một lượng dư kim loại Na thu được 3,36 dm3 khí H2 ở đktc. Công thức hóa học của rượu X là
A. CH3OH.
B. C2H5OH.
C. C3H7OH.
D. C4H9OH.
Câu 13: Để đốt chày hoàn toàn 0,1 mol một rượu X thuộc cùng dãy đồng đẳng với rượu etylic (có công thức tổng quát CnH2n+2O) thì cần 10,08 lít khí O2 ở đktc. Công thức phân tử của rượu X là
A. CH4O.
B. C3H8O.
C. C4H10O.
D. C2H6O.
Câu 14: Công thức cấu tạo của rượu etylic là
A. CH2 – CH3 – OH.
B. CH3 – O – CH3.
C. CH2 – CH2 – OH2.
D. CH3 – CH2 – OH.
Câu 15: Trong 100 ml rượu 40° có chứa
A. 40 ml nước và 60 ml rượu nguyên chất.
B. 40 ml rượu nguyên chất và 60 ml nước.
C. 40 gam rượu nguyên chất và 60 gam nước.
D. 40 gam nước và 60 gam rượu nguyên chất.
Bài viết trên đây đã cung cấp đầy đủ thông tin về tính chất, cấu tạo phân tử, ứng dụng và cách điều chế của rượu etylic (C2H6O) – một chất được ứng dụng vô cùng phổ biến xung quanh chúng ta. Hi vọng những thông tin này sẽ giúp bạn có thêm những kiến thức bổ ích và ứng dụng chúng trong học tập cũng như thực tiễn.
