Phenol là một hợp chất hóa học quan trọng thường xuất hiện trong các bài thi môn Hóa học. Cùng Wikihoc nắm vững các kiến thức trọng tâm về phenol thông qua cấu tạo, tính chất, cách điều chế và những ứng dụng phổ biến của phenol trong bài viết này.
Định nghĩa phenol là gì và cấu tạo của phenol
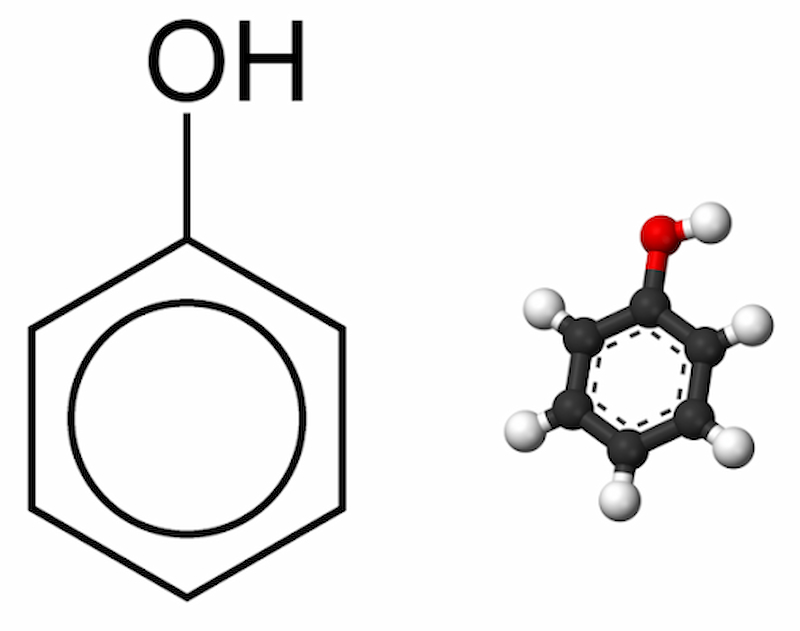
Phenol là những hợp chất hữu cơ mà trong phân tử có nhóm -OH liên kết trực tiếp với nguyên tử cacbon của vòng benzen. Nhóm -OH liên kết trực tiếp với nguyên tử cacbon của vòng benzen được gọi là -OH phenol.
-
Công thức phân tử: C6H6O
-
Công thức cấu tạo: C6H5OH
Phenol đơn giản nhất là C6H5-OH. Thông thường, chúng ta chỉ xét phenol đơn giản nhất là C6H5OH. Ngoài ra, còn có crezol CH3–C6H4–OH và HO-C6H4-OH (o-catechol, m-rezoxinol, p-hidroquinol).
Chú ý: Cần phân biệt giữa phenol và ancol thơm (có vòng benzen nhưng nhóm OH liên kết với C trong nhánh).
Phân loại phenol như thế nào?
Dựa theo số nhóm -OH trong phân tử, phenol được phân loại thành 2 loại chính là:
-
Phenol đơn chức (monophenol): Đây là những phenol trong công thức phân tử chỉ chứa 1 nhóm -OH. Ví dụ như: P-crezol, m-crezol, o-crezol…
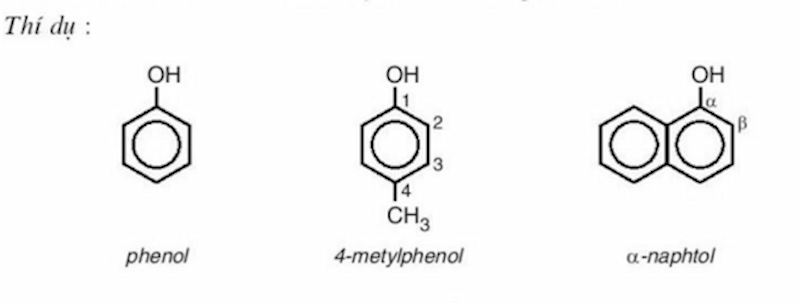
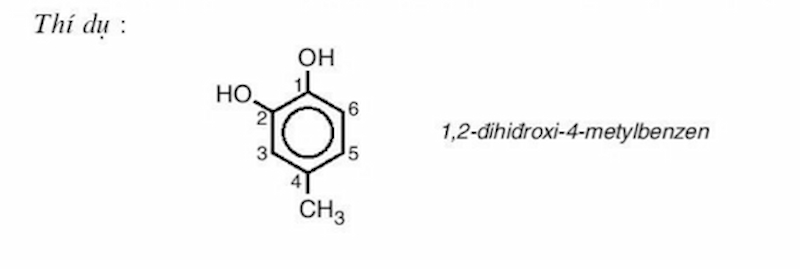
- Phenol đa chức (polyphenol): Đây là những phenol mà trong công thức phân tử chứa hai hoặc nhiều nhóm -OH.
Tính chất vật lý của phenol
Trong điều kiện thường, phenol tồn tại dưới dạng tinh thể rắn, độc không màu và có mùi đặc trưng.
-
Phenol sẽ bị oxi hóa nếu để lâu ngoài không khí. Lúc này, phenol sẽ chuyển thành hồng và bị chảy rữa vì chúng hút hơi nước ngoài môi trường.
-
Nhiệt độ nóng chảy: 43°C.
-
Phenol ít tan trong nước lạnh nhưng lại tan hoàn toàn trong nước nóng (khoảng 66°C) và tan trong một số chất hữu cơ khác.
Tính chất hóa học của phenol
Có hai tính chất hóa học quan trọng của phenol mà chúng ta cần ghi nhớ: Phản ứng thế nguyên tử H của nhóm -OH và mang tính chất của vòng Benzen.
Phản ứng thế nguyên tử H của nhóm -OH
Tính chất này được thể hiện khi cho phenol tác dụng với kim loại kiềm hoặc dung dịch bazơ.
-
Tác dụng với kim loại kiềm:
Tiến hành thí nghiệm: Cho một mẩu natri vào ống nghiệm chứa phenol nóng chảy. Ta thấy hiện tượng khí hidro thoát ra với phản ứng:
2C6H5OH + 2Na → 2C6H5ONa + H2 (nhiệt độ)
Đây là phản ứng dùng để phân biệt phenol và anilin.
-
Tác dụng với dung dịch bazơ:
Tiến hành thí nghiệm: Lấy một ít phenol vào 2 ống nghiệm. Thêm 1-2ml H2O vào ống thứ nhất, 2ml dung dịch NaOH đặc vào ống thứ 2. Lắc đều hai ống, ta thấy hiện tượng: Ống thứ nhất, mẩu phenol không thay đổi và ống thứ hai, mẩu phenol tan hết.
Kết luận:
-
Phenol không tan trong nước lạnh nhưng tan trong NaOH theo phản ứng:
C6H5OH + NaOH → C6H5ONa + H2O
-
Phenol có tính axit, tuy nhiên rất yếu (không làm đổi màu quỳ tím).
-
Vòng benzen làm tăng khả năng phản ứng của nguyên tử H thuộc nhóm -OH trong phân tử phenol so với trong phân tử ancol.
Phản ứng thế nguyên tử H của vòng benzen
Tiến hành thí nghiệm: Nhỏ nước brom vào dung dịch phenol, lắc nhẹ. Ta quan sát thấy hiện tượng kết tủa trắng. Phản ứng diễn ra như sau:
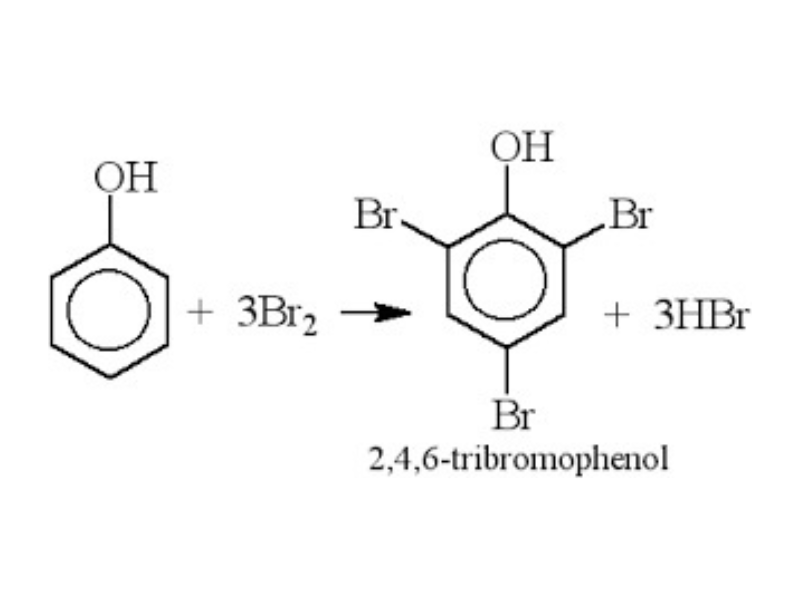
Tiếp tục cho HNO3 vào dung dịch phenol, thấy kết tủa vàng của axit picric (2,4,5-trinitrophenol).
C6H5OH + 3HNO3 → C6H2(NO2)3OH + 3H2O
Kết luận: Nguyên tử H của vòng Benzen trong phân tử phenol dễ bị thay thế hơn nguyên tử H của vòng benzen trong phân tử các hidrocacbon thơm. Đây là ảnh hưởng của nhóm -OH tới vòng benzen, được gọi là ảnh hưởng qua lại giữa các nguyên tử trong phân tử.
Chú ý: Ngoài phenol, tất cả những chất thuộc nhóm phenol còn nguyên tử H ở vị trí o, p so với nhóm OH đều có thể tham gia vào phản ứng thế brom và thế nitro.
Cách điều chế phenol
Trong công nghiệp, phenol được điều chế bằng cách phản ứng oxi hóa cumen nhờ oxi không khí, sau đó thủy phân trong dung dịch H2SO4 loãng. Sản phẩm thu được là phenol và axeton. Đun nóng axeton bay hơi sau đó ngưng tụ hơi thu được lấy axeton, còn lại là phenol. Phản ứng diễn ra như sau:
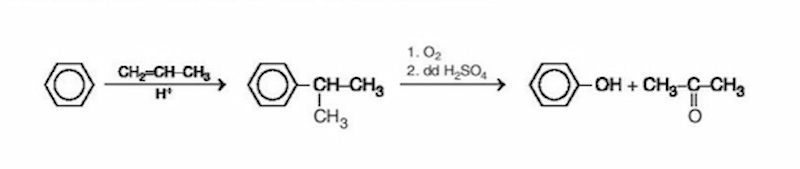
Bên cạnh đó, phenol còn được điều chế từ:
-
Điều chế từ benzen qua chuỗi phản ứng:
C6H6 + Br2 → C6H5Br + HBr (bột Fe)
C6H5Br + 2NaOH (đặc) → C6H5ONa + NaBr + H2O (nhiệt độ, áp suất)
C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3
-
Tách phenol từ nhựa than đá:
Người ta tiến hành cho nhựa than đá phản ứng với dung dịch NaOH dư. Sau đó, từ từ tách chiết để thu lớp nước chứa C6H5ONa. Cuối cùng, cho C6H5ONa + H+ để thu được phenol.
Xem thêm:
- Ankin là gì? Lý thuyết và giải bài tập chi tiết
- Ankadien: Hướng dẫn lý thuyết và giải bài tập chi tiết
Những ứng dụng phổ biến nhất của phenol trong công nghiệp, đời sống
Phenol mang nhiều ứng dụng trong cuộc sống và công nghiệp. Dưới đây là một số ứng dụng phổ biến nhất của phenol mà chúng ta cần nhớ.

-
Nguyên liệu sản xuất nhựa phenol formaldehyde hay nhựa poly dùng để chế tạo đồ dân dụng và chất kết dính (keo dán gỗ, dán kim loại, sành, sứ…)
-
Sản xuất phẩm nhuộm, thuốc nổ (axit picric).
-
Tổng hợp tơ polyamide trong ngành công nghiệp hóa học.
-
Điều chế và sản xuất chất kích thích tăng trưởng ở thực vật, kích thích tố thực vật 2, 4 – D – một loại chất có khả năng diệt cỏ dại.
-
Ứng dụng làm chất sát trùng hay điều chế những sản phẩm giúp diệt nấm mốc và sâu bọ.
Giải đáp phenol có độc không?
Phenol là một chất rất độc, có khả năng gây bỏng nặng khi rơi vào da. Phenol và các dẫn xuất của chúng đều là các chất độc hại cực kỳ nguy hiểm cho sức khỏe con người và hầu hết mọi sinh vật sống.
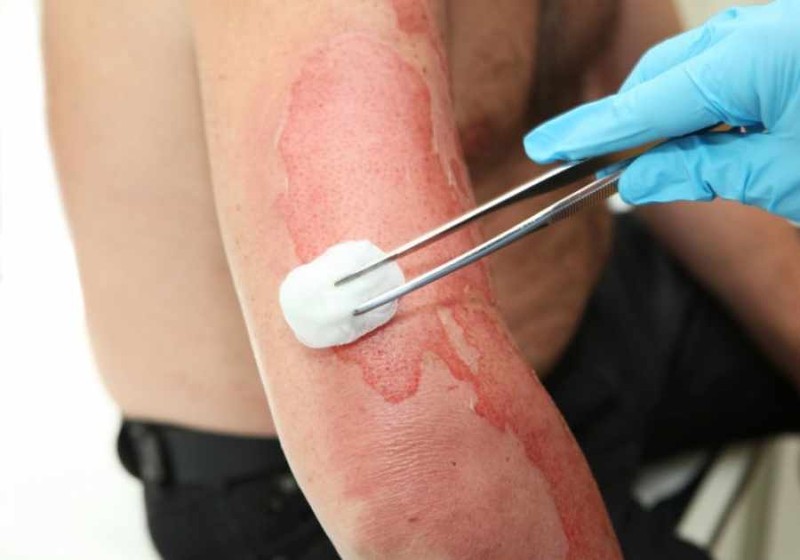
-
Với môi trường: Phenol là chất xếp vào loại chất gây ô nhiễm cao, chúng tích luỹ trong cơ thể sinh vật và gây nhiễm độc cấp tính, mãn tính cho con người.
-
Với con người: Khi xâm nhập vào cơ thể, các phenol sẽ gây ra nhiều tổn thương cho các cơ quan khác nhau nhưng điển hình nhất là tác động lên hệ thần kinh, máu và hệ thống tim mạch.
Phenol có tác dụng ăn mòn tại chỗ và ức chế chuyển hoá.
-
Liều nguy hiểm: Từ 2 – 5gam
-
Liều gây chết người: Trên 10gam.
Một số lưu ý khi sử dụng hóa chất Phenol
Phenol là một hóa chất cực kỳ độc hại nên chúng ta cần lưu ý đặc biệt khi sử dụng chất này để tránh gặp phải những ảnh hưởng nghiêm trọng. Không để phenol tiếp xúc trực tiếp với cơ thể, khi sử dụng phenol cần trang bị đầy đủ các biện pháp bảo hộ cần thiết theo quy định.
-
Không hít hoặc nuốt phải phenol.
-
Trong trường hợp bị phenol dính vào mắt hoặc da, cần rửa mắt ngay với nhiều nước ít nhất trong 15 phút. Sau đó đến ngay cơ sở y tế gần nhất để được kiểm tra và điều trị kịp thời.
Bài tập về phenol SGK Hóa học 11 kèm lời giải chi tiết
Sau khi tìm hiểu chi tiết những lý thuyết cơ bản về phenol ở phần trên, những bài tập thực hành trong SGK Hóa học 11 dưới đây sẽ giúp bạn đọc ôn tập sâu kiến thức này thông qua những phương pháp giải hay, ngắn gọn.

Giải bài 2 SGK Hóa 11 trang 193
Từ benzen và các chất vô cơ cần thiết có thể điều chế được các chất sau:
2,4,6-tribomphenol (1) ;
2,4,6-trinitrophenol (2)
Viết phương trình hóa học của các phản ứng xảy ra.
Gợi ý đáp án:
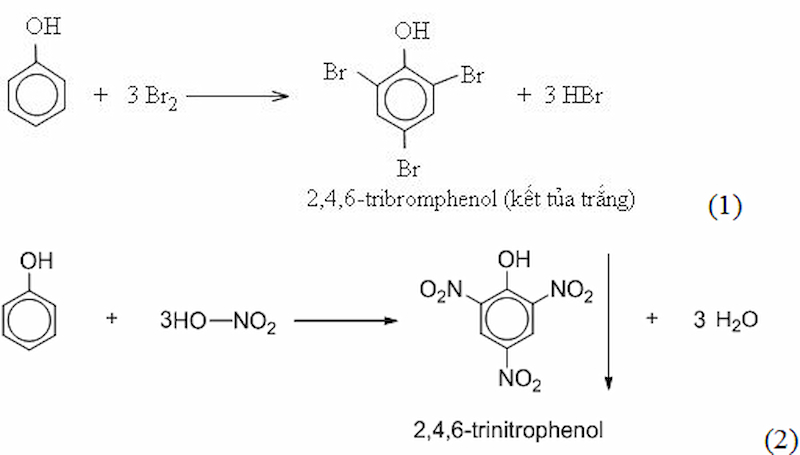
Giải bài 3 SGK trang 193 Hóa 11
Cho 14,0 gam hỗn hợp A gồm phenol và etanol tác dụng với natri dư thu được 2,24 lít khí hidro (đktc)
a. Viết các phương trình hóa học xảy ra.
b. Tính thành phần phần trăm khối lượng của mỗi chất trong A.
c. Cho 14,0 gam hỗn hợp A tác dụng với HNO3 thì thu được bao nhiêu gam axit picric (2,4,6- trinitrophenol)?
Gợi ý đáp án:
a. Gọi số mol của phenol và etanol lần lượt là x và y (mol)
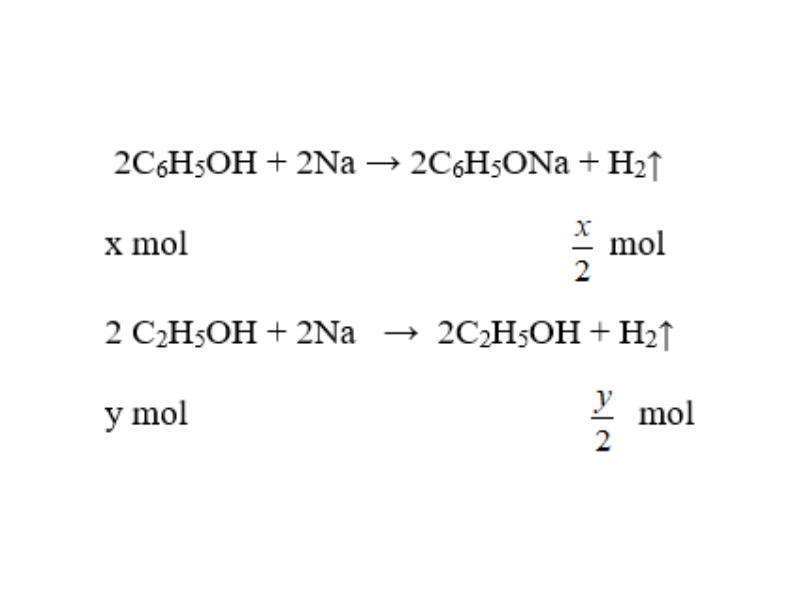
b. Theo đề bài ta có hệ phương trình:
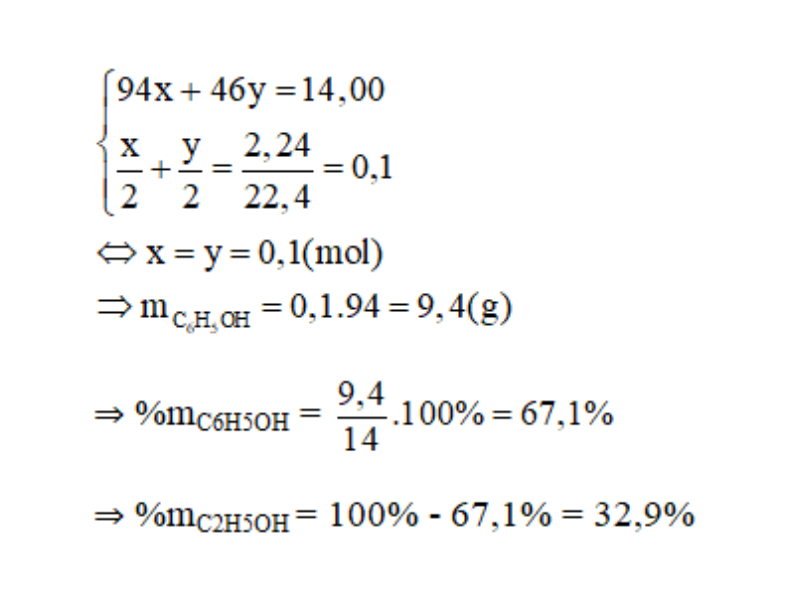
c.
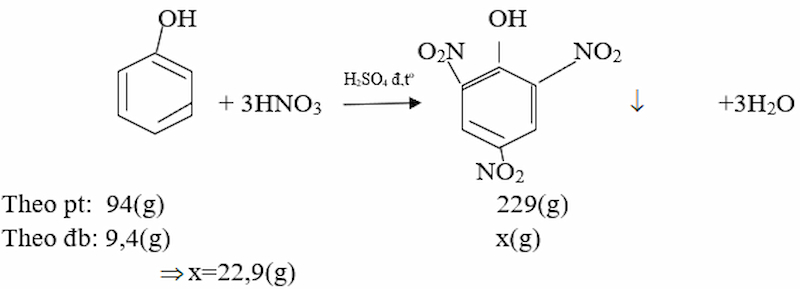
Vậy ta sẽ thu được 22,9 g axit picric.
Giải bài 4 trang 193 Hóa 11 SGK
Cho từ từ phenol vào nước brom; stiren vào dung dịch brom trong CCl4. Nêu hiện tượng và viết các phương trình hóa học.
Gợi ý đáp án:
Khi cho phenol vào nước brom thì có kết tủa trắng xuất hiện:
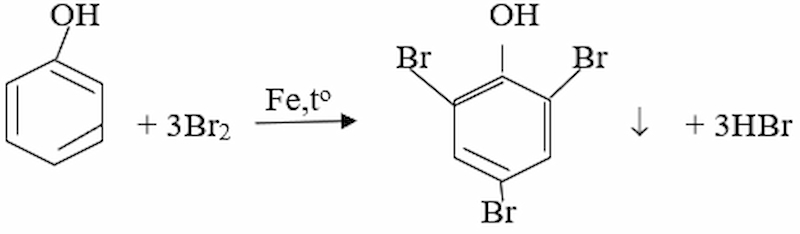
- Khi cho stiren vào dung dịch brom trong CCl4 thì dung dịch brom bị nhạt màu, do:
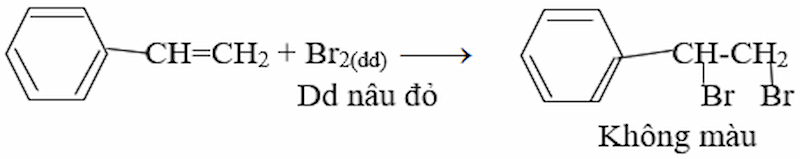
Giải bài 5 Hóa 11 SGK trang 193
Sục khí CO2 vào dung dịch natri phenolat thấy dung dịch vẩn đục, trong dung dịch có NaHCO3 được tạo thành. Viết phương trình hóa học của phản ứng xảy ra và giải thích. Nhận xét về tính axit của phenol.
Gợi ý đáp án:
C6H5ONa + CO2 + H2O → C6H5OH ↓ + NaHCO3 (Điều kiện: Nhiệt độ)
-
Dung dịch bị vẩn đục là do phản ứng tạo ra phenol.
-
Nhận xét về tính axit của phenol: Phenol có tính axit yếu hơn nấc thứ nhất của axit cacbonic H2CO3, nên bị axit cacbonic đẩy ra khỏi dung dịch muối.
Như vậy, bài viết trên đây đã cung cấp cho bạn đọc những kiến thức cơ bản cần nhớ về phenol. Hy vọng bài viết này sẽ giúp bạn đọc nắm chắc các thông tin về loại hợp chất này và áp dụng thành thạo trong các bài tập Hóa học cũng như thực tiễn đời sống. Chúc bạn có một quá trình học tập hiệu quả và đừng quên chia sẻ bài viết nếu thấy có ích!
