Clo là phi kim hoạt động hóa học mạnh nằm ở bên phải bảng tuần hoàn các nguyên tố hóa học. Bài viết dưới đây của Wikihoc sẽ tổng hợp những thông tin chi tiết về tính chất, ứng dụng, cách điều chế và các bài tập vận dụng thực hành để bạn đọc hiểu rõ Clo là gì. Đừng bỏ qua những kiến thức thú vị dưới đây!
Định nghĩa Clo là gì?
Clo là nguyên tố hóa học, nằm ở ô số 17, chu kì 3 trong bảng tuần hoàn nguyên tố có ký hiệu hóa học là Cl. Nguyên tử khối của Clo là 35.5 và công thức phân tử là Cl2. Đây là nguyên tố rất phổ biến và có nhiều ứng dụng trong cuộc sống cũng như trong công nghiệp.
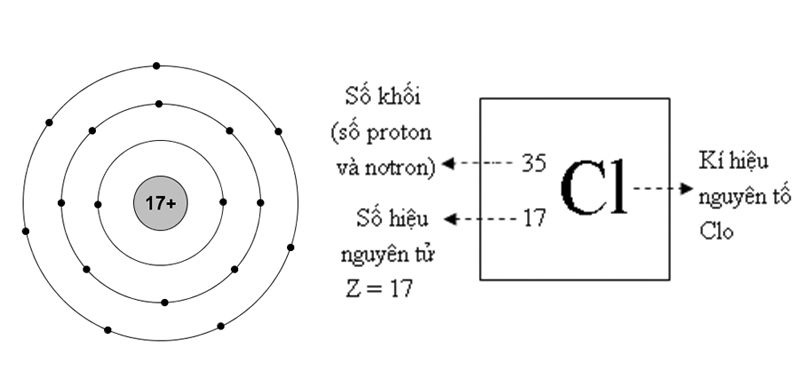
Tính chất vật lý của Clo
Tìm hiểu Clo là gì không thể bỏ qua những tính chất vật lý quan trọng của nguyên tố này. Một số tính chất nổi bật của Clo bao gồm:
-
Màu sắc và trạng thái: Clo là chất khí, màu vàng lục, mùi hắc.
-
Khối lượng: Clo nặng gấp 2.5 lần không khí.
-
Tính tan: Clo có thể tan trong nước. Ở 20 độ C, một thể tích nước hòa tan 2.5 thể tích khí Clo.
-
Tính độc: Clo là khí độc.
Tính chất hóa học của Clo
Nhìn chung, Clo có những tính chất hóa học của một phi kim (tác dụng với hầu hết kim loại, tác dụng mạnh với hidro) tạo thành muối Clorua, có thể tác dụng với nước, dung dịch NaOH. Đây là một phi kim hoạt động mạnh. Cụ thể các tính chất hóa học của phi kim Clo là:
Tác dụng với kim loại
Clo có thể tác dụng với hầu hết kim loại tạo thành muối clorua. Ví dụ như Clo có thể thể tác dụng với kim loại sắt tạo thành sắt (III) clorua, tác dụng với kim loại đồng tạo thành đồng (II) clorua.
Phương trình hóa học:
Tác dụng với hidro
Khí Clo dễ dàng phản ứng với hidro tạo thành khí hidro clorua. Khí hidro clorua tan nhiều trong nước tạo thành dung dịch axit clohidric (HCl).
Ta có phương trình hóa học như sau:
Chú ý: Clo không phản ứng trực tiếp với oxi.
Tác dụng với nước
Để chứng minh Clo có thể tác dụng với nước, SGK Hóa học 9 đã trình bày chi tiết thí nghiệm dẫn khí Clo vào cốc đựng nước sau đó nhúng mẩu giấy quỳ tím vào dung dịch thu được. Quan sát hiện tượng thấy rõ dung dịch nước Clo có màu vàng lục, mùi hắc của khí Clo và làm đổi màu quỳ tím thành đỏ sau đó lại mất ngay. Như vậy, ta có thể kết luận rằng phản ứng Clo với nước xảy ra theo 2 chiều ngược nhau.
Nước Clo là dung dịch hỗn hợp các chất: Cl2, HCl, HCLO nên có màu vàng lục, mùi hắc của khí Clo. Sở dĩ quỳ tím chuyển màu đỏ và nhanh chóng bị mất đi sau đó là bởi tác dụng oxi hóa mạnh của HClO (axit hipoclorơ).
Tác dụng với NaOH
Chứng minh tác dụng hóa học của khí clo tác dụng với dung dịch NaOH, thực hiện thí nghiệm dẫn khí clo vào ống nghiệm đựng NaOH. Tiếp tục nhỏ 1-2 giọt dung dịch vừa tạo thành vào quỳ tím. Quan sát hiện tượng ta thấy dung dịch tạo thành không có màu và giấy quỳ tím mất màu. Như vậy, có thể kết luận rằng Clo đã phản ứng với dung dịch NaOH. Phương trình phản ứng:
Trong phương trình hóa học trên, Clo có màu vàng lục; dung dịch NaOH, NaCl, NaClO đều không màu. Dung dịch hỗn hợp của 2 muối natri clorua (HCl) và natri hipoclorit (NaClO) được gọi là nước Gia-ven. Đây là dung dịch có tính tẩy màu, tương tự như HClO và NaClO là chất oxi hóa mạnh.
Ứng dụng quan trọng của Clo trong thực tiễn
Nguyên tố phi kim Clo có khá nhiều ứng dụng trong đời sống và sản xuất. Một số ứng dụng phổ biến là:

-
Khử trùng nước sinh hoạt: Đây là phương pháp khá hiệu quả, đơn giản, dễ thực hiện và tiết kiệm. Để đảm bảo an toàn, hàm lượng sử dụng để khử trùng nước sinh hoạt cần tuân thủ đúng quy chuẩn.
-
Tẩy trắng vải sợi, bột giấy: Xuất phát từ tính oxi hóa mạnh, Clo có khả năng tẩy trắng vải sợi, bột giấy, có ý nghĩa quan trọng trong sản xuất.
-
Điều chế nhựa PVC, chất dẻo, cao su, chất màu: Đây là ứng dụng quan trọng của Clo trong công nghiệp.
-
Điều chế nước Gia-ven: Đây là chất tẩy hàng đầu mà nhiều người vẫn sử dụng để tẩy các vết ố vàng, bẩn trên quần áo, khử trùng bồn cầu, đồ gia dụng hay vệ sinh nhà cửa.
Xem thêm:
- Phi kim là gì? Tìm hiểu chi tiết về tính chất của chúng
- Oxit axit: Định nghĩa, cách gọi tên, tính chất và bài tập thực hành
- Muối là gì? Tổng hợp kiến thức từ A-Z và bài tập thực hành
Điều chế Clo như thế nào?
Trong tự nhiên, Clo chỉ tồn tại ở dạng hợp chất. Vì vậy người ta thường sử dụng các hợp chất của nó để điều chế.
Cách điều chế Clo trong phòng thí nghiệm
Để điều chế khí Clo trong phòng thí nghiệm, thực hiện đun nóng nhẹ dung dịch HCl đậm đặc với chất oxi hóa mạnh, ví dụ như mangan (IV) oxit (MnO2) hoặc KMnO4. Quan sát sẽ thấy khí màu vàng lục, mùi hắc xuất hiện. Khí Clo được làm khô bằng axit sunfuric H2SO4 đặc và thu vào bình bằng cách đẩy không khí.
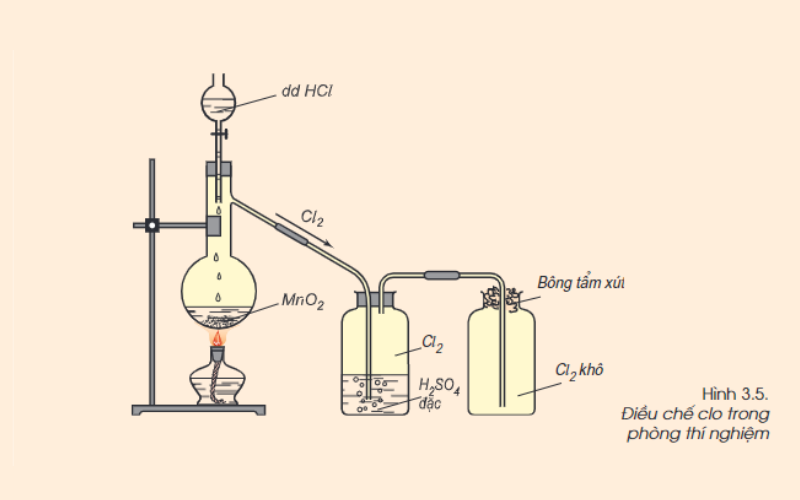
Trong phản ứng trên MnO2 có màu đen; MnCl2 không màu; Cl2 có màu vàng lục.
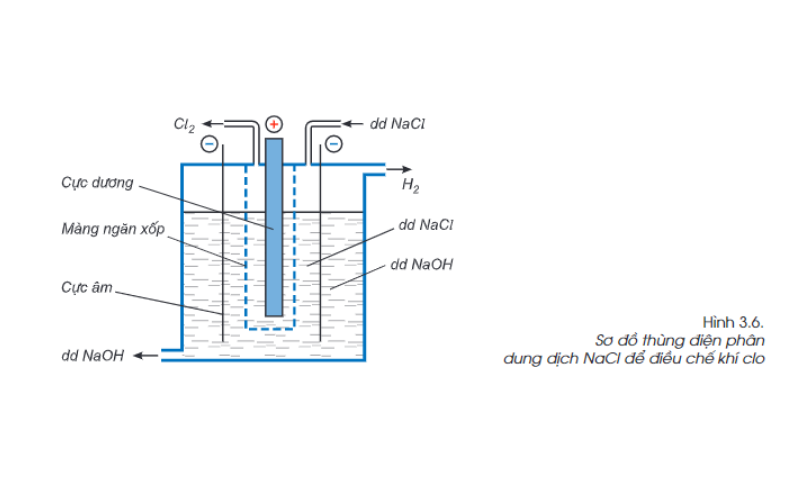
Cách điều chế Clo trong công nghiệp
Trong công nghiệp, khí Clo được điều chế bằng phương pháp điện phân dung dịch natri clorua (NaCl) bão hòa có màng ngăn xốp. Khí Clo thu được ở cực dương, khí hidro thu được ở cực âm, dung dịch là NaOH.
Ta có phương trình phản ứng như sau:
Tại Việt Nam, khí Clo được sản xuất nhiều tại nhà máy hóa chất Việt trì, nhà máy giấy Bãi Bằng.
Bài tập về khí Clo SGK Hóa học 9 kèm lời giải
Với những kiến thức lý thuyết Clo là gì ở trên chắc hẳn các bạn đã có thể tự tin làm các bài tập trong sách giáo khoa cũng như sách bài tập để ôn luyện kiến thức và chuẩn bị cho những bài thi. Dưới đây là một vài bài tập về khí Clo SGK hóa học 9 kèm đáp án chi tiết mà Wikihoc tổng hợp để bạn đọc có thể tham khảo:

Bài tập 1 (SGK Hóa học 9, trang 81)
Khi dẫn khí Clo vào nước xảy ra hiện tượng vật lí hay hiện tượng hóa học? Giải thích.
Gợi ý đáp án:
Dẫn khí Clo vào nước, vừa là hiện tượng vật lý, vừa là hiện tượng hóa học, vì có tạo thành chất mới là HCl và HClO cũng như có khí Clo tan trong nước.
Bài tập 2 (SGK Hóa học 9, trang 81)
Nếu tính chất hóa học của Clo. Viết các phương trình hóa học minh họa.
Gợi ý đáp án:
Các tính chất hóa học của Clo gồm:
- Tác dụng với kim loại:
- Tác dụng với hiđro:
- Tác dụng với nước:
- Tác dụng với dung dịch NaOH:
Bài tập 3 (SGK Hóa học 9, trang 81)
Viết phương trình hóa học khi cho Clo, lưu huỳnh, oxi với sắt ở nhiệt độ cao. Cho biết hóa trị của sắt trong những hợp chất tạo thành.
Gợi ý đáp án:
Bài tập 4 (SGK hóa học 9, trang 81)
Sau khi làm thí nghiệm, khí Clo dư được loại bỏ bằng cách sục khí Clo vào:
a) Dung dịch HCl; b) Dung dịch NaOH; c) Dung dịch NaCl; d) Nước.
Trường hợp nào đúng? Hãy giải thích.
Gợi ý đáp án:
Trường hợp đúng là đáp án b (dung dịch NaOH). Vì dung dịch này phản ứng được với khí Clo tạo thành muối.
Trên đây là toàn bộ thông tin lý thuyết và một số bài tập thực hành Clo là gì. Hy vọng những thông tin chia sẻ trên đây đã giúp các bạn hiểu hơn về nguyên tố phi kim này, ôn tập và đạt điểm tốt trong các bài kiểm tra. Ghé đọc Website của Wikihoc thường xuyên để tham khảo thêm nhiều kiến thức môn học hữu ích tiếp theo bạn nhé!
