Bài viết cung cấp cho bạn đọc những thông tin tổng hợp chi tiết nhất về cân bằng hóa học và sự chuyển dịch cân bằng hóa học cũng như cách vận dụng nguyên lý Lơ Sa–tơ–li-ê để xét đoán sự chuyển dịch cân bằng hóa học. Cùng Wikihoc tìm hiểu ngay!
Cân bằng hóa học là gì? Phản ứng một chiều và phản ứng thuận nghịch
Để hiểu rõ về cân bằng hóa học là gì, chúng ta sẽ tìm hiểu về phản ứng một chiều và phản ứng thuận nghịch.
Phản ứng một chiều là gì?
Làm rõ khái niệm về phản ứng một chiều, chúng ta sẽ xem xét phản ứng sau đây:
2KClO3 -> 2KCl + 3O2 (Điều kiện: MnO2, nhiệt độ)
Khi đun nóng các tinh thể Kali Clorat (KClO3) có mặt chất xúc tác Mangan dioxit (MnO2), KClO3 sẽ phân hủy thành kali clorua (KCl) và oxi (O2). Cũng trong điều kiện đó, Kali Clorua (KCl) và oxi (O2) không phản ứng được với nhau tạo lại KClO3. Như vậy, phản ứng chỉ xảy ra theo một chiều từ trái sang phải, phản ứng như vậy được gọi là phản ứng một chiều.
Trong phương trình hóa học của phản ứng một chiều, người ta dùng một mũi tên chỉ chiều phản ứng.
Phản ứng thuận nghịch
Để làm rõ khái niệm phản ứng thuận nghịch là gì? Chúng ta sẽ xét phản ứng sau:
Cl2 + H2O ⇌ HCl + HClO
Ở điều kiện thường thì Cl2 sẽ phản ứng với nước (H2O) tạo thành HCl và HClO, đồng thời HCl và HClO sinh ra cũng tác dụng được với nhau tạo lại Cl2 và H2O. Như vậy, trong cùng điều kiện, phản ứng xảy ra theo hai chiều trái ngược nhau. Phản ứng như vậy được gọi là phản ứng thuận nghịch.
Trong phương trình hóa học của phản ứng thuận nghịch, người ta sử dụng mũi tên ngược chiều nhau thay cho mũi tên đối với phản ứng một một chiều.
Cân bằng hóa học là gì?
SGK hóa học 10 (NXB Giáo dục Việt Nam) đã định nghĩa chi tiết về cân bằng hóa học như sau: “Cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch”.
Để hiểu rõ hơn về khái niệm này, chúng ta sẽ xem xét phản ứng thuận nghịch sau:
H2 (k) + I2 (k) ⇌ 2HI (k)
Cho H2 và I2 vào trong một bình kín ở nhiệt độ cao và không đổi. Lúc đầu tốc độ phản ứng thuận (Vt) lớn vì nồng độ H2 và I2 lớn, trong khi đó tốc độ phản ứng nghịch (Vn) bằng không, vì nồng độ HI bằng không. Trong quá trình diễn ra phản ứng, nồng độ H2 và I2 giảm dần vì vậy Vt giảm dần còn Vn sẽ tăng dần do nồng độ HI tăng dần. Đến một lúc nào đó, Vt trở nên bằng Vn, khi đó nồng độ các chất trong phản ứng thuận nghịch trên đây được giữ nguyên, nếu nhiệt độ không biến đổi. Trạng thái này của phản ứng thuận nghịch được gọi là cân bằng hóa học.
Ở trạng thái cân bằng, không phải là phản ứng dừng lại mà phản ứng thuận và phản ứng nghịch vẫn xảy ra nhưng với tốc độ bằng nhau (Vt = Vn). Điều này có nghĩa là trong một đơn thời gian, nồng độ các chất phản ứng giảm đi bao nhiêu theo phản ứng thuận lại được tạo ra bấy nhiêu theo phản ứng nghịch. Do đó, cân bằng hóa học là cân bằng động.
Đặc điểm của phản ứng thuận nghịch là các chất phản ứng không chuyển hóa hoàn toàn thành các sản phẩm, nên trong hệ cân bằng luôn có mặt các chất phản ứng và các sản phâm.
Ví dụ, cho 0.5 mol/l H2 và 0.5 mol/l I2 vào trong một bình kín ở nhiệt độ 430 độ C. Nếu phản ứng là một chiều thì H2 và I2 sẽ phản ứng hết tạo thành 1 mol/l HI. Tuy nhiên đây là phản ứng thuận nghịch nên chỉ thu được 0.786 mol/l HI và còn lại 0.107 mol/l H2, 0.107 mol/l I2.
Sự chuyển dịch trong cân bằng hóa học
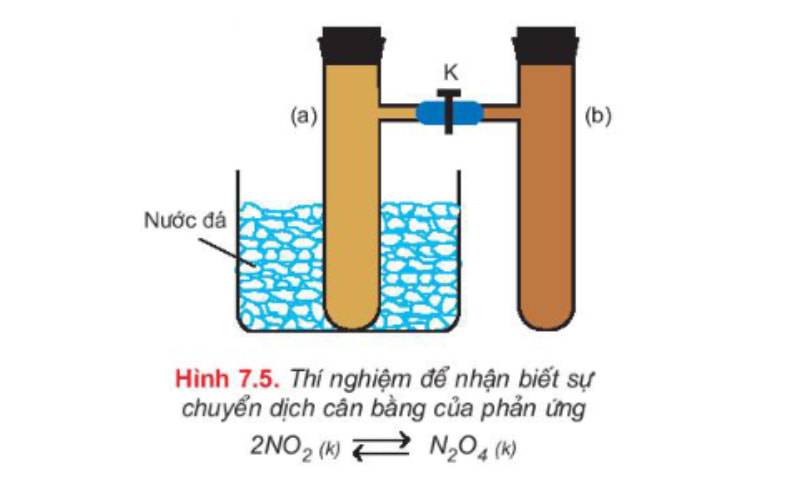
Thực hiện thí nghiệm lắp bộ dụng cụ gồm hai ống nghiệm có nhánh (a) và (b), được nối với nhau bằng một ống nhựa mềm, có khóa K mở. Tiếp tục nạp đầy khí NO2 vào cả hai ống (a) và (b) ở nhiệt độ thường. Nút kín cả hai ống, trong đó có cân bằng sau:
2NO2 (k – nâu đỏ) ⇌ N2O4 (khí – không màu)
Màu của hỗn hợp khí trong cân bằng ở cả hai ống (a) và (b) là như nhau. Thực hiện đóng khóa K lại để ngăn không cho khí ở hai ống khuếch tán vào nhau. Ngâm ống (a) vào nước đá một lát sau lấy ra so sánh thấy màu ở ống (a) với ống (b) nhận thấy ống (a) có màu nhạt hơn.
Khi làm lạnh ống (a), các phân tử NO2 trong ống đã phản ứng thêm để tạo ra N2O4, làm nồng độ NO2 giảm bớt và nồng độ N2O4 tăng thêm. Hiện tượng đó được gọi là sự chuyển dịch cân bằng hóa học.
Kết luận: Sự chuyển dịch cân bằng hóa học là sự di chuyển từ trạng thái cân bằng này sang trạng thái cân bằng khác do tác động của các yếu tố bên ngoài lên cân bằng (SGK Hóa học 10, trang 158, NXB Giáo dục Việt Nam).
Các yếu tố ảnh hưởng đến cân bằng hóa học
Những yếu tố làm chuyển dịch cân bằng là nồng độ, áp suất và nhiệt độ. Chúng được gọi là các yếu tố ảnh hưởng đến cân bằng hóa học. Cụ thể như sau:
Ảnh hưởng của nồng độ
Xét hệ cân bằng sau trong một bình kín ở nhiệt độ cao và không đổi:
C (r) + CO2 (k) ⇌ 2CO (k)
Khi hệ phản ứng đang ở trạng thái cân bằng, nghĩa là Vt = Vn, nồng độ các chất trong phản ứng không biến đổi nữa. Nếu ta cho thêm vào hệ một lượng khí CO2, nồng độ CO2 trong hệ sẽ tăng lên làm chon gay lúc đó Vt bằng Vn, lúc đó cân bằng được thiết lập. Ở trạng thái cân bằng mới, nồng độ các chất sẽ khác với trạng thái cân bằng cũ.
Vậy khi thêm CO2 vào hệ cân bằng, cân bằng sẽ chuyển dịch theo chiều từ trái sang phải (theo chiều thuận), chiều làm giảm nồng độ CO2 thêm vào. Quá trình chuyển dịch cân bằng xảy ra tương tự khi ta lấy bớt khí CO ra khỏi cân bằng, vì khi đó Vn < Vt. Ngược lại, nếu ta cho thêm khí CO vào hoặc lấy bớt khí CO2 ra khỏi hệ cân bằng thì lúc đó Vt < Vn, cân bằng sẽ chuyển dịch từ phải sang trái (theo chiều nghịch), nghĩa là theo chiều làm giảm nồng độ CO hoặc chiều tăng nồng độ CO2.
Kết luận: Khi tăng hoặc giảm nồng độ một chất trong cân bằng thì cân bằng bao giờ cũng chuyển dịch theo chiều làm giảm tác động của việc tăng hoặc giảm nồng độ của chất đó. Trường hợp trong hệ cân bằng có chất rắn ở dạng nguyên chất thì việc thêm hoặc bớt lượng chất rắn không ảnh hưởng đến cân bằng, nghĩa là cân bằng không chuyển dịch.
Ảnh hưởng của áp suất
Xét hệ cân bằng bên dưới trong xi lanh kín có pít tông ở nhiệt độ thường và không đổi:
N2O4 (k) ⇌ 2NO2 (k)
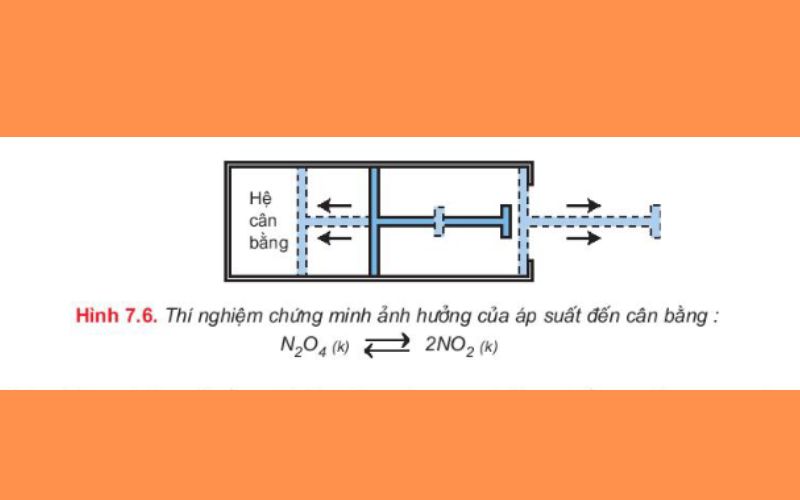
Thí nghiệm chứng tỏ rằng khi hệ đang ở trạng thái cân bằng, nếu ra tăng áp suất chung của hệ lên, bằng cách đẩy pít tông vào để cho thể tích chung của hệ giảm xuống thì số mol khí NO2 sẽ giảm bớt, đồng thời số mol khí N2O4 sẽ tăng thêm, nghĩa là cân bằng chuyển dịch theo chiều nghịch.
Kết luận:Khi tăng hoặc giảm áp suất chung của hệ cân bằng thì cân bằng bao giờ cũng chuyển dịch theo chiều làm giảm tác động của việc tăng hoặc giảm áp suất đó.
Như vậy, nếu phản ứng có số mol khí ở hai vế của phương trình hóa học bằng nhau hoặc phản ứng không có chất khí thì áp suất không ảnh hưởng đến cân bằng. Ví dụ, áp suất đến các cân bằng sau:
H2 (k) + I2 (k) ⇌ 2HI (k)
Fe2O3 (r) + 3CO (k) ⇌ 2Fe (r) + 3CO2 (k)
Ảnh hưởng của nhiệt độ
Để nghiên cứu ảnh hưởng của nhiệt độ đến cân bằng hóa học chúng ta cần biết khái niệm phản ứng tỏa nhiệt và phản ứng thu nhiệt.
.jpg)
-
Phản ứng tỏa nhiệt: Là phản ứng hóa học thường kèm theo sự giải phóng hoặc hấp thụ năng lượng dưới dạng nhiệt. Ví dụ: Cho vôi sống CaO tác dụng với nước H2O, hỗn hợp tạo thành sôi lên.
-
Phản ứng thu nhiệt: Là phản ứng hóa học ta phải liên tục cung cấp nhiệt cho phản ứng đó. Ví dụ: Thực hiện nung đá vôi (CaCO3) để sản xuất vôi sống.
Để chỉ lượng nhiệt kèm theo những phản ứng hóa học, người ta dùng đại lượng nhiệt phản ứng, ký hiệu là ΔH<0. Ở phản ứng tỏa nhiệt, các chất phản ứng mất năng lượng nên giá trị ΔH<0 (giá trị âm). Ngược lại phản ứng thu nhiệt, các chất phản ứng phải lấy thêm năng lượng để tạo ra các sản phẩm nên ΔH>0 (giá trị dương).
Để nghiên cứu ảnh hưởng của nhiệt độ đến cân bằng hóa học, xét cân bằng trong bình kín:
N2O4 (khí – không màu) ⇌ 2NO2 (khí – nâu đỏ); ΔH = 58 kJ
Phản ứng thu nhiệt ΔH = 58 kJ >0; phản ứng nghịch tỏa nhiệt ΔH = -58 kJ <0
Kết luận:
-
Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều phản ứng thu nhiệt, nghĩa là chiều giảm tác động của việc tăng nhiệt độ và khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều phản ứng tỏa nhiệt, chiều làm giảm tác động của việc giảm nhiệt độ.
-
Ba yếu tố nồng độ, áp suất và nhiệt độ ảnh hưởng tới cân bằng hóa học đã được nhà hóa học Pháp H. Le Chatelier tổng kết thành nguyên lý chuyển dịch cân bằng Lơ Sa-tơ-li-ê: “Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó” (Theo SGK Hóa học 10, trang 161).
Sự tham gia của các chất xúc tác
Chất xúc tác làm tăng tốc độ phản ứng thuận và tốc độ phản ứng nghịch với số lần bằng nhau. Vì vậy, chất xúc tác không ảnh hưởng đến cân bằng hóa học. Khi phản ứng thuận nghịch chưa ở trạng thái cân bằng thì chất xúc tác có tác dụng làm cho cân bằng được thiết lập nhanh chóng hơn.
Xem thêm:
- Tổng hợp bảng tuần hoàn các nguyên tố hóa học 8 9 10 MỚI NHẤT
- Số oxi hóa là gì? 4 quy tắc xác định số oxi hóa của 1 nguyên tố
Ý nghĩa của tốc độ phản ứng và cân bằng hóa học trong sản xuất hóa học
Để thấy ý nghĩa của tốc độ phản ứng và cân bằng hóa học trong sản xuất hóa học, chúng ta lấy ví dụ sau đây:
Ví dụ: Trong quá trình sản xuất axit sunfuric phải thực hiện phản ứng sau:
2SO2 (k) + O2 (k) ⇌ 2SO3 (k)
Trong phản ứng này người ta dùng oxi không khí.
Ở nhiệt độ thường, phản ứng xảy ra rất chậm. Vì thế, để tăng tốc độ phản ứng phải dùng chất xúc tác và thực hiện phản ứng ở nhiệt độ khá cao. Do đây là phản ứng tỏa nhiệt nên khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều nghịch làm giảm giảm hiệu suất của phản ứng. Để hạn chế tác dụng này, người ta đã dùng một lượng dư không khí, nghĩa là tăng nồng độ oxi, làm cho cân bằng chuyển dịch theo chiều thuận.
Bài tập về cân bằng hóa học SGK Hóa 10 kèm lời giải chi tiết
Dựa vào kiến thức lý thuyết Wikihoc đã tổng hợp từ SGK Hóa học 10 trên đây, các bạn hãy tiếp tục thực hành làm bài tập và so sánh với gợi ý đáp án chi tiết nhé!

Bài 1 (SGK hóa học 10, trang 162)
Ý nào sau đây là đúng:
A. Bất cứ phản ứng nào cũng phải đạt đến trạng thái cân bằng hóa học.
B. Khi phản ứng thuận nghịch ở trạng thái cân bằng thì phản ứng dừng lại.
C. Chỉ có những phản ứng thuận nghịch mới có trạng thái cân bằng hóa học.
D. Ở trạng thái cân bằng, khối lượng các chất ở hai vế của phương trình phản ứng phải bằng nhau.
Gợi ý đáp án:
Đáp án đúng là C.
Bài 2 (SGK Hóa học, trang 162)
Hệ cân bằng sau được thực hiện trong bình kín:
2SO2(k) + O2 (k) ⇄ 2SO3 (k) ΔH < 0
Yếu tố nào sau đây không làm nồng độ các chất trong hệ cân bằng biến đổi?
A. Biến đổi nhiệt độ.
B. Biến đổi áp suất.
C. Sự có mặt chất xúc tác.
D. Biến đổi dung tích của bình phản ứng.
Gợi ý đáp án:
Đáp án là C. Sự có mặt chất xúc tác. Chất xúc tác làm tăng tốc độ phản ứng thuận và tốc đọ phản ứng nghịch với số lần bằng nhau. Do vậy, chất xúc tác không làm chuyển dịch cân bằng hóa học hay không làm nồng độ các chất trong cân bằng biến đổi
Bài 3 (SGK Hóa học 10, trang 163)
Cân bằng hóa học là gì? Tại sao nói cân bằng hóa học là cân bằng động?
Gợi ý đáp án:
Cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Cân bằng hóa học là cân bằng động vì: Ở trạng thái cân bằng không phải là phản ứng dừng lại, mà phản ứng thuận nghịch và phản ứng nghịch vẫn xảy ra, nhưng tốc độ bằng nhau (V thuận = V nghịch). Điều này có nghĩa là trong một đơn vị thời gian số mol chất phản ứng giảm đi bao nhiêu theo phản ứng thuận lại được tạo ra bấy nhiêu theo phản ứng nghịch. Do đó cân bằng hóa học là cân bằng động.
Trên đây là tổng hợp chi tiết lý thuyết và một số bài tập về cân bằng hóa học. Chúc các bạn ôn tập hiệu quả và đạt kết quả cao trong học tập!
