Ankadien tạo ra nhiều hợp chất mang tính đàn hồi cao như cao su với ứng dụng quan trọng trong nhiều lĩnh vực trong đời sống. Vậy Ankadien là gì? Cùng tìm hiểu khái niệm, tính chất hóa học và phương pháp điều chế của ankadien qua bài viết dưới đây.
Định nghĩa ankadien là gì?
Ankadien được định nghĩa là hidrocacbon không no dạng mạch hở. Trong phân tử hợp chất này chứa 2 liên kết đôi.
-
Công thức tổng quát: CnH2n-2 (với n≥ 3).
-
Tên gọi: Cách gọi tên Ankadien tổng quát là: Số chỉ vị trí nhánh – tên nhánh + tên mạch chính + a – số chỉ vị trí nối đôi – dien
-
Ví dụ:
CH2 = C = CH2: Propadien
CH2 – C = CH – CH3: buta -1,2 – dien
CH2 = CH – CH = CH2: buta -1,3 – dien
Phân loại ankađien
Dựa vào vị trí tương đối giữa hai liên kết đôi, Ankadien có thể được chia thành 3 loại:
-
Ankadien có 2 liên kết đôi cạnh nhau: -C=C=C-. Ví dụ: Anlen CH2 = C = CH2.
-
Ankadien liên hợp với hai liên kết đôi cách nhau bởi 1 liên kết đơn: -C=C-C=C-
Công thức tổng quát của Ankadien liên hợp: CnH2n-2 (với n≥ 4).
Ví dụ: Các ankadien liên hợp như bita-1,3đien CH2=CH-CH=CH2 và isopren CH2=C(CH3)-CH=CH2 được nhắc đến phổ biến với nhiều ứng dụng thực tế.
Butadien: CH2 = CH-CH = CH2
Isopren: CH2 = C – CH = CH2
|
CH3
-
Ankadien có 2 liên kết đôi cách nhau từ 2 liên kết đơn trở lên: -C=C-C-C=C-. Ví dụ: penta – 1,4-đien CH2 = CH-CH2-CH=CH2
3 tính chất hóa học quan trọng của ankadien
Đâu là những tính chất hóa học quan trọng của ankadien mà bạn cần nhớ? Cùng tìm hiểu 3 tính chất đặc trưng của ankadien thông qua: Phản ứng cộng, phản ứng trùng hợp của halogen và phản ứng oxi hóa halogen.

Phản ứng cộng của ankadien
Tương tự anken, buta-1,3-đien có thể tham gia phản ứng cộng với hidro (khi có xúc tác niken), halogen và hidro halogenua. Tùy theo điều kiện, phản ứng sẽ xảy ra tại một trong hai liên kết đôi (cộng 1,2) hoặc cộng vào hai đầu ngoài của hai liên kết đôi (cộng 1,4) hoặc cộng đồng thời vào hai liên kết đôi.
Cộng hidro
CH2=CH – CH=CH2 + 2H2 → CH3 – CH2 – CH2 – CH3 (Ni, nhiệt độ)
Cộng brom
Ankadien có khả năng cộng 1.2 ở điều kiện nhiệt độ -80oC và cộng 1.4 ở điều kiện 40oC.
-
Cộng 1.2:
CH2=CH – CH=CH2 + Br2 (dd) → CH2=CH-CHBr-CH2Br (-80 độ C)
-
Cộng 1.4:
CH2=CH-CH=CH2 + Br2 (dd) → CH2Br – CH=CH-CH2Br (40 độ C)
-
Cộng đồng thời vào 2 liên kết nối đôi:
CH2=CH – CH = CH2 + 2Br2 (dd) → CH2Br – CHBr – CHBr – CH2Br
Cộng hidro halogen
-
Cộng 1.2:
CH2 = CH – CH = CH2 = HBr → CH2 = CH – CHBr – CH3 (-80 độ C)
-
Cộng 1.4:
CH2 = CH – CH = CH2 + HBr → CH3 – CH = CH – CH2Br (40 độ C)
(sản phẩm chính)
Phản ứng trùng hợp của halogen
Khi có mặt kim loại natri hoặc các chất xúc tác, buta-1.3- đien sẽ tham gia phản ứng trùng hợp, chủ yếu theo kiểu 1,4:
nCH2=CH-CH=CH2 → (-CH2-CH=CH-CH2-)n (polobutaddien) Điều kiện: Nhiệt độ, p, xúc tác.
Phản ứng oxi hóa halogen
Trong tính chất hóa học của ankadien, phản ứng oxi hóa halogen cũng là một tính chất quan trọng, bao gồm: Phản ứng oxi hóa hoàn toàn và phản ứng oxi hóa không hoàn toàn.
-
Phản ứng oxi hóa hoàn toàn
Ví dụ: 2C4H6 + 11O2 → 8CO2 + 6H2O (nhiệt độ)
-
Phản ứng oxi hóa không hoàn toàn.
Tương tự anken, Buta-1,3-đien và isopren cũng làm mất màu dung dịch kali pemanganat KMnO4.
2 cách điều chế ankadien
Có hai phương pháp điều chế ankadien chủ yếu, đó là:

-
Điều chế buta-1,3-đien từ butan hoặc butilen theo phương trình:
CH3 – CH2 – CH2 – CH3 → CH2=CH-CH=CH2 + 2H2 (nhiệt độ, xúc tác)
-
Điều chế isopren bằng cách tách hidro của isopentan theo phương trình:
CH3 – CH(CH3) – CH2 – CH3 → CH2 = C (CH3) – CH = CH2 + 2H2 (xúc tác, nhiệt độ)
Ứng dụng của ankadien trong đời sống
Các ankadien liên hợp như buta-1,3dien CH2=CH-CH=CH2 và isopren CH2=C(CH3)-CH=CH2 có nhiều ứng dụng thực tế. Nhờ phản ứng trùng hợp đặc trưng, hai hợp chất này có thể điều chế ra polibutadien hoặc pollosopren là những chất có tính đàn hồi cao, được dùng để sản xuất cao su như cao su buna, cao su isopren… Cao su buna được sử dụng trong việc làm lốp xe, nhựa trám thuyền.
Xem thêm:
- Ankan: Định nghĩa, tính chất, ứng dụng và cách điều chế
- Xicloankan: Cấu tạo phân tử, tính chất, ứng dụng và cách điều chế
Bài tập về ankadien SGK Hóa học 11 kèm lời giải chi tiết
Những bài tập Hoá học 11 dưới đây sẽ giúp bạn đọc nắm chắc lý thuyết và ôn tập sâu kiến thức về ankadien thông qua những hướng dẫn giải bài tập bằng các phương pháp giải hay, ngắn gọn nhất.
.jpg)
Giải bài 1 trang 135 SGK Hóa 11
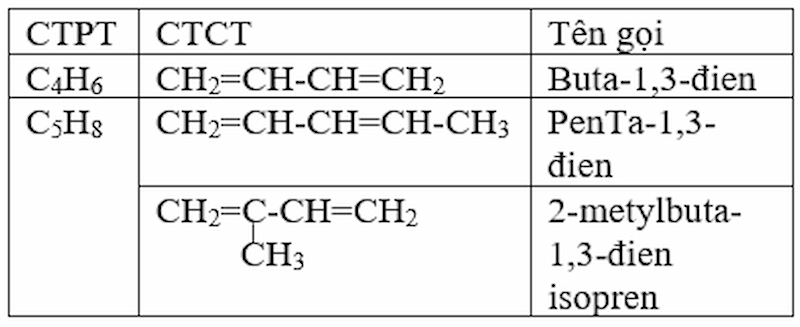
Thế nào là ankađien, ankađien liên hợp? Viết công thức cấu tạo và gọi tên các ankađien liên hợp có công thức phân tử C4H6, C5H8
Gợi ý đáp án:
Định nghĩa :
-
Ankađien là hiđrocacbon mạch hở có hai liên kết đôi C=C trong phân tử.
-
Ankađien có hai liên kết đôi cách nhau 1 liên kết đơn được gọi là ankađien liên hợp.
Giải bài 2 SGK Hóa 11 trang 135
Viết phương trình hóa học ( ở dạng công thức cấu tạo) của các phản ứng xảy ra khi:
a. Isopren tác dụng với hidro (xúc tác Ni)
b. Isopren tác dụng với brom trong (trong CCl4) Các chất được lấy theo tỉ lệ số mol 1 : 1 tạo ra sản phẩm theo kiểu cộng 1, 4.
c. Trùng hợp isopren theo kiểu 1,4.
Gợi ý đáp án:
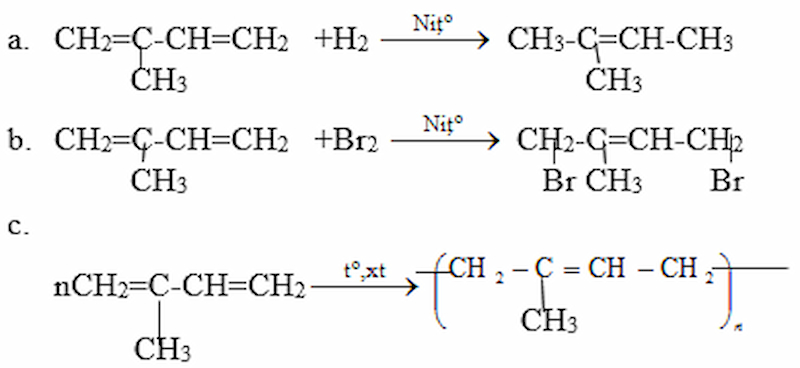
Giải bài 3 SGK trang 135 Hóa 11
Oxi hóa hoàn toàn 0,680 gam ankađien X thu được 1,120 lít CO2 (đktc)
a. Tìm công thức phân tử của X
b. Tìm công thức cấu tạo có thể có của X
Gợi ý đáp án:
a. Gọi CTPT của ankađien X là CnH2n-2 (n ≥ 3)
nCO2 = 1.12/ 22.4 = 0.05mol
CnH(2n-2) + (3n-1)/2 x O2 → NCO2 + (n-1)H2O
Theo PT: (14n-2) g n mol
Theo đề bài: 0.68 0.05mol
⇒ (14n-2).0,05 = 0,68.n ⇒ n = 5 ⇒ CTPT X: C5H8
b. CTCT có thể có của X là:
CH2=C=CH-CH2-CH3
CH2=CH-CH=CH-CH3
CH2=CH-CH2-CH=CH2
CH3-CH=C=CH-CH3
CH2= C(CH)-CH = CH2
Giải bài 4 trang 135 Hóa 11 SGK
Khi cho buta-1,3-đien tác dụng với H2 ở nhiệt độ cao, có Ni làm xúc tác, có thể thu được
A. Butan ; B. Isobutan ; C. Isobutilen ; D. Pentan
Lời giải: Đáp án A
PTHH: CH2=CH-CH=CH2 + 2H2 → CH3-CH2-CH2-CH3 (Ni, nhiệt độ)
Giải bài 5 Hóa 11 SGK trang 136
Hợp chất nào sau đây cộng hợp H2 tạo thành isopentan?
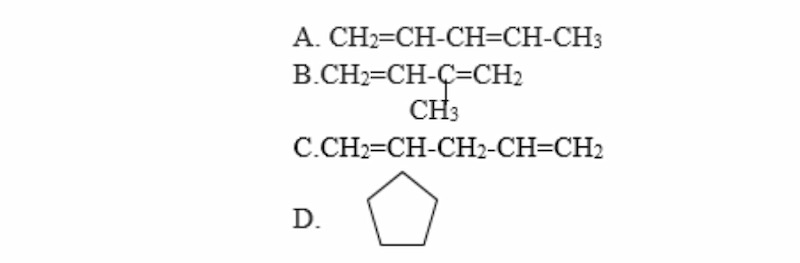
Gợi ý đáp án: Đáp án B
PTHH:
CH2=CH-C(CH3)=CH2 + 2H2 → CH3-CH2-CH(CH3)-CH3 (Ni, nhiệt độ)
Trên đây là những kiến thức cơ bản và quan trọng nhất về ankadien, bao gồm: Ankadien là gì, phân loại, tính chất, điều chế và ứng dụng của chúng. Wikihoc chúc bạn có thể vận dụng tốt những kiến thức thú vị này trong những bài tập thực hành môn Hóa học cũng như thực tiễn đời sống. Nhấn NHẬN CẬP NHẬT ở phần đầu trang để không bỏ lỡ những thông tin bổ ích khác về môn Hóa học nhé!
