Ancol hay còn được biết đến với tên quen thuộc là rượu, là một trong những hợp chất hữu cơ quan trọng nhất. Để có thể thành thạo các dạng bài tập liên quan đến Ancol, dưới đây là những kiến thức cơ bản và đầy đủ nhất về ancol.
Định nghĩa ancol là gì? Ancol gồm những loại nào?
Ancol là những hợp chất hữu cơ mà trong đó, phân tử có nhóm hiđroxyl (-OH) liên kết trực tiếp với nguyên tử cacbon no, với công thức R(OH)n.
Ví dụ: CH2=CHCH2OH, C6H5CH2OH, CH3OH, C2H5OH,…
Công thức chung của Ancol có các dạng chính:
-
CxHyOz (Điều kiện: x, y, z là các số tự nhiên; y chẵn và 4 ≤ y ≤ 2x + 2; z ≤ x). Công thức này được dùng khi viết phản ứng cháy.
-
CxHy(OH)z hay R(OH)z: Được dùng khi viết phản ứng xảy ra trong nhóm OH.
-
CnH2n+2-2k-z(OH)z (Điều kiện: k = số liên kết proton + số vòng; n, z là các số tự nhiên; z ≤ n). Công thức này thường dùng để viết phản ứng cộng Br2, cộng H2, khi đã biết rõ số chức; no hay không no,…
-
CnH2n+1OH hay CnH2n+2O (n ≥ 1): Công thức tổng quát của ancol no, đơn chức, mạch hở.
Ancol gồm những loại nào?
-
Theo gốc hiđrocacbon: Ancol được phân loại thành ancol no, ancol không no, ancol thơm.
-
Theo số lượng nhóm hiđroxyl: Ancol được chia ra thành ancol đơn chức và ancol đa chức.
-
Bậc của ancol = bậc của nguyên tử C liên kết với nhóm -OH.
Một số loại ancol tiêu biểu mà chúng ta có thể kể đến, đó là:
-
Ancol no, đơn chức, mạch hở: Phân tử có nhóm “-OH” liên kết với gốc ankyl (CnH2n+1-OH).
Ví dụ: CH3-OH, C3H7-OH,…
-
Ancol không no, đơn chức, mạch hở: Phân tử có nhóm “-OH” liên kết với gốc cacbon no của hidrocacbon không no.
Ví dụ: CH3-CH=CH-CH2-OH, CH2=CH-CH2-OH,…
-
Ancol thơm, đơn chức: Phân tử có phân nhánh “-OH” liên kết với nguyên tử cacbon no thuộc mạch nhánh của vòng benzen.
Ví dụ:
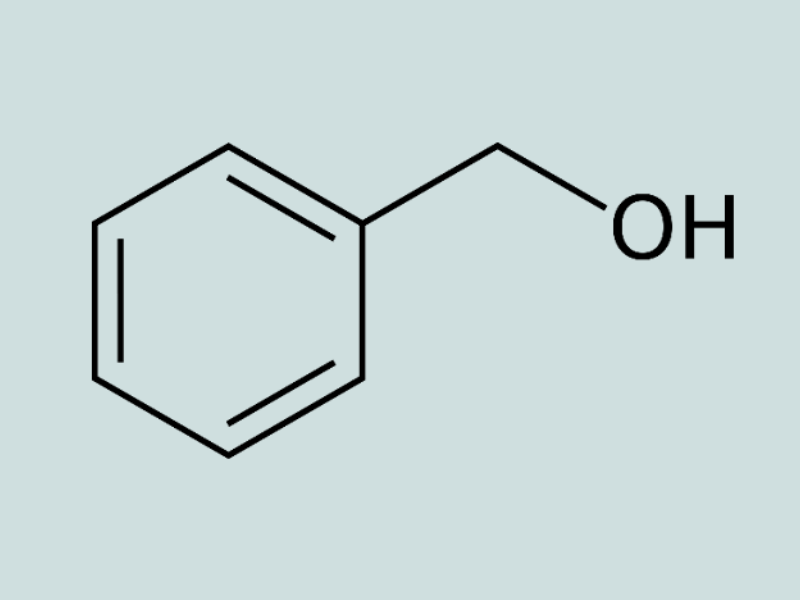
-
Ancol vòng no, đơn chức: Phân tử Ancol chứa một nhóm “-OH” liên kết với nguyên tử cacbon no thuộc gốc hidrocacbon vòng no.
Ví dụ:
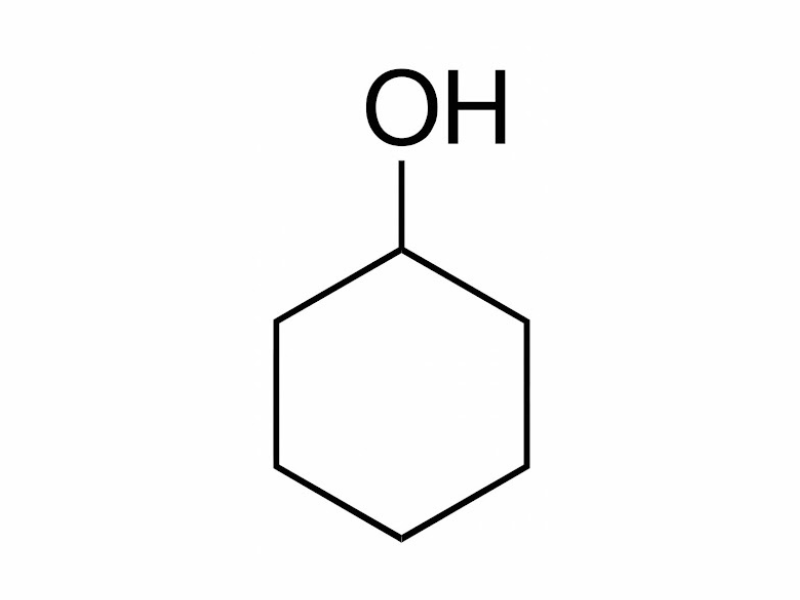
-
Ancol đa chức: Phân tử chứa từ 2 nhóm “-OH” Ancol trở lên. Tùy theo bậc nguyên tử cacbon no liên kết với nhóm “-OH”, các Ancol này được chia thành: Ancol bậc I, Ancol bậc II và Ancol bậc III.
Ví dụ:
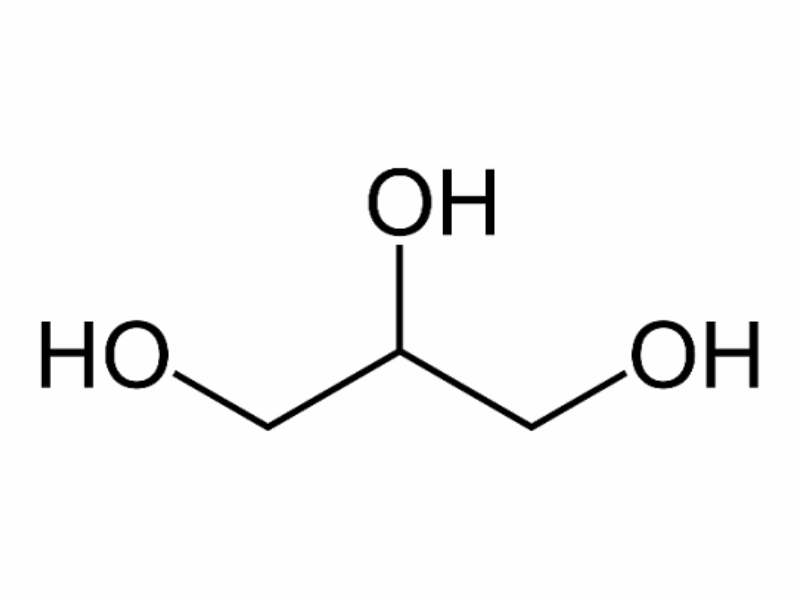
Đồng phân và danh pháp của ancol
Trước khi tìm hiểu các tính chất của ancol, chúng ta cùng tìm hiểu đồng phân và cách gọi tên của chúng.
Đồng phân của ancol
Các ancol no mạch hở, đơn chức có đồng phân mạch cacbon và đồng phân vị trí nhóm chức -OH trong mạch Cacbon. Ngoài ra, ancol đơn chức có đồng phân là ete: R-O-R’.
Ví dụ:
Viết đồng phân của C4H10O, ta có:
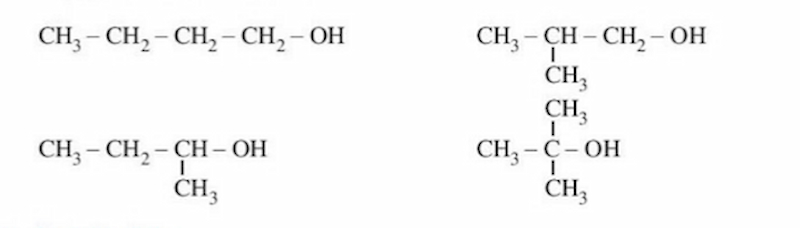
Ví dụ, viết đồng phân của C3H8O, ta có:
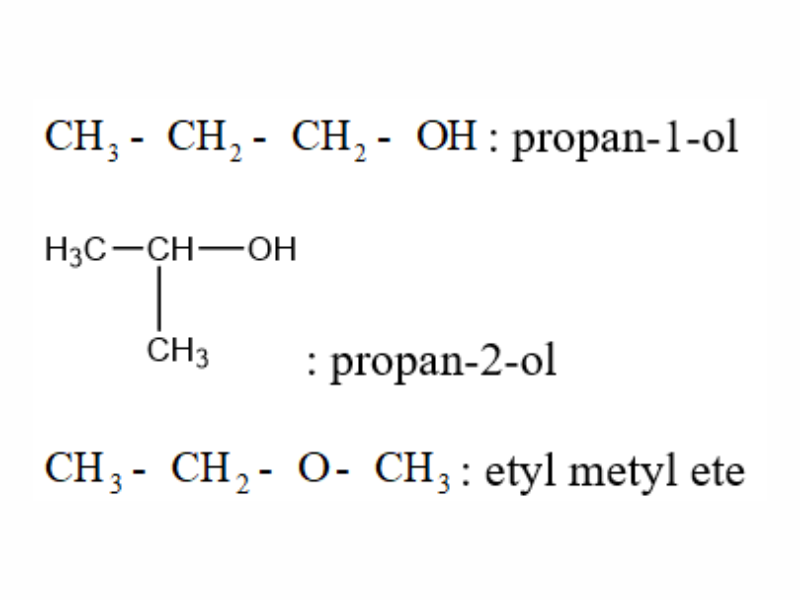
Danh pháp ancol
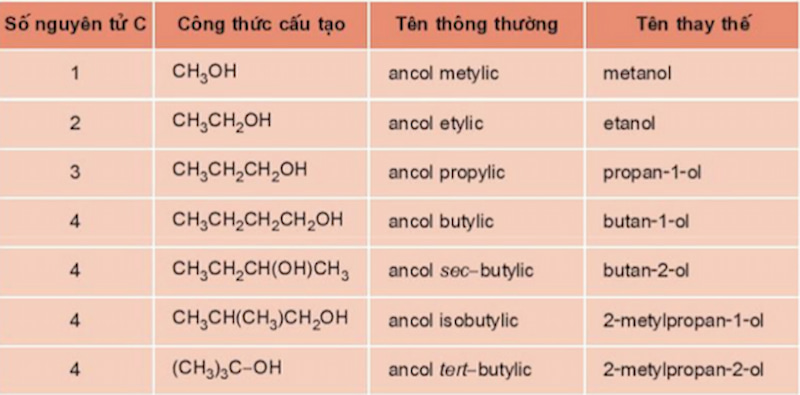
Cách gọi tên ancol như sau:
Tên gọi thường = Ancol (rượu) + Tên gốc ankyl + ic
Ví dụ:
CH3-CH2-OH: Ancol etylic.
CH3-OH: Ancol metylic.
Ngoài ra, dưới đây là một số Ancol có tên gọi đặc biệt bạn cần lưu ý:
-
CH2OH-CH2OH: Etilenglicol
-
CH2OH-CHOH-CH2OH: Glixerin hay còn được gọi là Glixerol
-
CH3-CH(CH)3-CH2-CH2OH: Ancol Isoamylic
Tên thay thế = Tên gọi hidrocacbon tương ứng + Chỉ số chỉ vị trí nhóm OH + ol.
Trong đó:
-
Mạch chính của Ancol là mạch cacbon dài nhất liên kết với nhóm -OH.
-
Các nguyên tử cacbon được đánh số thứ tự từ phía gần nhóm -OH hơn.
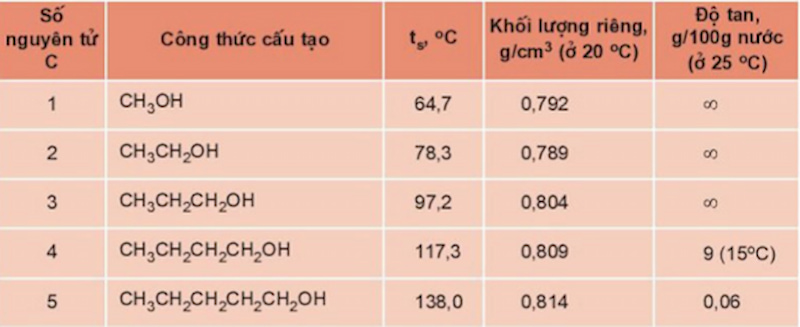
Tính chất vật lý của ancol
Dưới đây là những tính chất vật lý nổi bật của ancol bạn cần biết.
-
Trạng thái tồn tại: Đa số Ancol đều ở thể lỏng và thể rắn tùy vào số phân tử cacbon trong công thức. Từ C1 đến C12, ancol tồn tại dưới dạng chất lỏng và từ C13 trở lên là chất rắn.
-
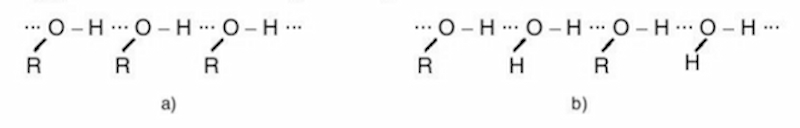
Nhiệt độ sôi: Ancol có nhiệt độ sôi cao hơn so với các hidrocacbon có cùng phân tử khối vì chúng có liên kết hidro liên phân tử. Khi so sánh với các chất có khối lượng phân tử tương tự nhau, nhiệt độ sôi của các hợp chất lần lượt là: Muối > Axit > Ancol > Andehit > Hidrocacbon, Ete hoặc Este,…
-
Độ tan: Ancol có 1, 2 hay 3 nguyên tử C trong phân tử sẽ tan vô hạn trong nước. Ancol có càng nhiều C, độ tan trong nước của chúng càng giảm vì tính kị nước của gốc hiđrocacbon tăng lên.
-
Nhiệt độ sôi, khối lượng riêng của ancol tăng dần theo chiều tăng của phân tử khối và độ tan trong nước của chúng giảm dần.
Tính chất hóa học của ancol
Trong phân tử, liên kết C – OH, đặc biệt là liên kết phân cực mạnh, nhóm -OH, nhất là nguyên tử H sẽ dễ dàng bị thay thế hoặc tách ra trong các phản ứng hóa học. Đây là yếu tố tạo nên những tính chất hóa học quan trọng của ancol.

Phản ứng thế H của nhóm OH
Phản ứng thế H của nhóm OH là một trong những tính chất hóa học nổi bật nhất của ancol.
Tính chất chung của ancol
Thí nghiệm: Cho một mẫu kim loại Natri vào ống nghiệm chứa 1 – 2ml Etanol khan và sau đó phản ứng giải phóng khí Hidro.
Phương trình: 2C2H5OH + 2Na → 2C2H50Na + H2
Hiện tượng: Đốt khí Hidro thoát ra ở đầu ống, ta quan sát thấy ngọn lửa xanh mờ xuất hiện: 2H2 + O2 → 2H2O (nhiệt độ)
Kết luận: Ancol phản ứng với kim loại kiềm.
Tính chất đặc trưng của glixerol
Thí nghiệm:
Bước 1: Cho vào hai ống nghiệm, mỗi ống từ 3 – 4 giọt dung dịch CuSO4 2% và 2 – 3ml dung dịch NaOH 10%, lắc nhẹ dung dịch. Trong cả hai ống nghiệm, ta quan sát thấy hiện tượng kết tủa xanh của Cu(OH)2:
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
Bước 2: Tiếp tục nhỏ vào ống thứ nhất 3 – 4 giọt Etanol, ống thứ hai 3 – 4 giọt Glixerol, lắc nhẹ cả hai ống nghiệm. Trong ống 1, ta nhận thấy kết tủa không tan và trong ống 2, ta quan sát được kết tủa tạo dung dịch xanh lam của muối đồng (II) Glixerat.
2C3H5(OH)3 + Cu(OH)2 → [(C3H5(OH)2O]2Cu + 2H2O
Kết luận: Như vậy, glixerol hòa tan đồng (II) hidroxit thành dung dịch có màu xanh lam mà etanol không có tính chất này. Phản ứng này giúp phân biệt ancol đơn chức với ancol đa chức có các nhóm -OH cạnh nhau trong phân tử.
Phản ứng thế nhóm OH
Tính chất “phản ứng thế nhóm OH” của ancol được chứng minh thông qua: Phản ứng với axit vô cơ và phản ứng với ancol.
Phản ứng với axit vô cơ
Thí nghiệm: Khi đun hỗn hợp axit Bromhidric và Etanol trong ống nghiệm có lắp ống dẫn khí ở nhánh, ta thu được chất lỏng không màu nặng hơn nước. Đây chính là Etyl Bromua: C2H5OH + HBr → C2H5Br + H2O
Như vậy, ancol phản ứng với axit vô cơ HX (Ancol + H2SO4, Ancol + HCl) theo công thức:
CnH(2n+2-2k-z)(OH)z + (z+k)HX → CnH(2n+2-z)X(z+k)
Trong đó: Số nguyên tử X sẽ bằng tổng số nhóm OH và số liên kết pi.
Ngoài ra, ancol còn phản ứng với axit hữu cơ, được gọi là phản ứng este hóa.
ROH +R’COOH ⇔ R’COOR + H2O
yR(OH)x + xR’(COOH)y ⇔ R’x(COO)xyRy + xyH2O
Chú ý:
-
Phản ứng chỉ được thực hiện trong môi trường axit và đun nóng.
-
Cần chú ý đến chuyển dịch cân bằng vì phản ứng có tính thuận nghịch.
Phản ứng với ancol
Thí nghiệm: Cho 1ml Etanol vào ống nghiệm khô, nhỏ từ từ 1ml axit H2SO4 đặc vào và lắc đều. Sau đó, đun hỗn hợp sôi nhẹ và đưa ống nghiệm ra xa ngọn lửa. Nhỏ từ từ giọt Etanol dọc theo ống nghiệm vào hỗn hợp đang cháy, ta quan sát thấy mùi đặc trưng của Ete Etylic.
Phương trình: C2H5 – OH + H – OC2H5 → C2H5 – O – C2H5 + H2O (H2SO4, 140 độ C)
Phản ứng tách nước
Khi tiến hành đun ancol etylic với axit H2SO4 đặc tới nhiệt độ khoảng 170 độ C, ta thu được khí etilen.
Phương trình: CH3 – CH2 – OH → CH2 = CH2 + H2O (H2SO4, 170 độ C)
Tính chất này được sử dụng để điều chế etilen trong phòng thí nghiệm.
Cũng trong điều kiện trên, các ancol no đơn chức mạch hở (trừ Metanol) có thể bị tách nước tạo thành Anken.
CnH(2n+ 1)OH → CnH2n + H2O (H2SO4, nhiệt độ)
Ancol no, đơn chức, mạch hở sẽ tách nước từ 1 phân tử tạo thành anken:
CnH2n+1OH = CnH2n + H2O (H2SO4 đặc, >170 độ C)
-
Điều kiện khi tham gia phản ứng này đó là phải có Hg.
-
Nếu ancol no, đơn chức mạch hở không tách nước tạo anken thì Ancol đó không có Ha (là CH3OH hoặc ancol mà nguyên tử C liên kết OH chỉ liên kết với C bậc 3 khác).
-
Nếu một ancol tách nước tạo ra hỗn hợp nhiều anken, đó là ancol bậc cao như bậc II, bậc III và mạch C không đối xứng qua C liên kết OH.
-
Khi nhiều ancol tách nước tạo ra một anken, có các khả năng sau xảy ra:
Phản ứng tách nước đặc biệt:
CH2OH-CH2OH → CH3CHO + H2O
CH2OH-CHOH-CH2OH → CH2=CH-CHO + 2H2O
Tách nước từ 2 phân tử ancol tạo ete
ROH + ROH → ROR + H2O (H2SO4 đặc, 140 độ C)
Chú ý:
-
Từ n ancol khác nhau, khi tách nước ta thu được n.(n + 1)/2 ete. Trong đó, có n ete đối xứng.
-
Khi tách nước thu được các ete có số mol bằng nhau, các ancol tham gia phản ứng sẽ có số mol bằng nhau và nAncol = 2.nete = 2.nH2O và nAncol = mete + nH2O + mAncol dư.
Phản ứng oxi hóa
Phản ứng oxi hóa cũng là một trong những tính chất hóa học quan trọng của ancol với:
-
Phản ứng oxi hóa không hoàn toàn (Ancol + CuO hoặc Ox có xúc tác là Cu)
Ancol bậc l + Cuo tạo ra anđehit: RCH2OH + CuORCHO + Cu + H2O
Ancol bậc II + CuO tạo ra xeton: RCHOHR’ + CuO – RCOR’ + Cu + H2O
Ancol bậc III không bị oxi hóa bằng CuO.
Chú ý: mchất rắn giảm = mCuO phản ứng – mCu tạo thành = 16.nAncol đơn chức
-
Phản ứng oxi hóa hoàn toàn
CxHyOz + (x + y/4 – z/2)O2 → xCO2 + y/2H2O
Trong phản ứng oxi hóa hoàn toàn của ancol, ta cần lưu ý:
Phản ứng đốt cháy của ancol có những đặc điểm tương tự phản ứng đốt cháy hidrocacbon tương ứng.
Nếu ta đốt cháy ancol và cho nH2O > nCO2, ancol được đốt cháy là ancol no và nAncol = nH2O – nCO2.
Nếu đốt cháy ancol cho nH2O > 1,5.nCO2, ancol được đốt cháy là CH3OH. Chỉ có CH4 và CH3OH mang những tính chất này (không tính amin).
Khi đốt cháy 1 hợp chất hữu cơ X, trong đó nH2O > nCO2 thì chất đó là ankan, ancol no mạch hở hoặc ete no mạch hở với cùng công thức CnH2n+2O4.
Xem thêm:
- Ankin là gì? Lý thuyết và giải bài tập chi tiết
- Ankadien: Hướng dẫn lý thuyết và giải bài tập chi tiết
2 phương pháp điều chế ancol
Ancol được tạo ra bằng cách nào? Cùng Wikihoc tìm hiểu 2 phương pháp điều chế ancol cơ bản.
Phương pháp tổng hợp
Được sử dụng trong nhiều nước công nghiệp phát triển, etanol thu được bằng cách tổng hợp etilen với phản ứng hợp nước có xúc tác H2SO4 hoặc H3PO4 trong nhiệt độ cao:
C2H4 + H2O → C2H5-OH (H2SO4, nhiệt độ)
Bên cạnh đó, người ta còn tổng hợp ancol bằng cách thủy phân dẫn xuất halogen trong dung dịch kiềm.
Tổng hợp glixerol từ propilen
Glixerol được điều chế từ propilen theo sơ đồ:
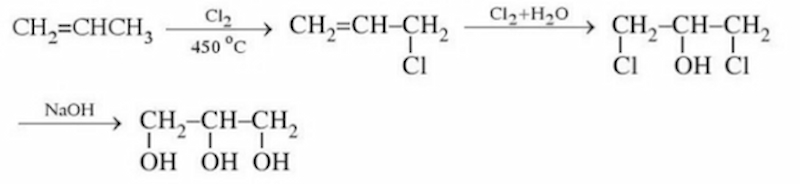
Bên cạnh đó, glixerol còn thu được từ phản ứng thủy phân chất béo trong quá trình xà phòng hóa chất béo.
Phương pháp sinh hóa
Etanol còn thu được qua phương pháp lên men từ các loại nông sản giàu tinh bột như gạo, ngô, khoai, sắn, quả chín… Theo sơ đồ:
(C6H10O5)n → C6H12O6 (H2O, nhiệt độ, xúc tác) → C2H5OH (xúc tác emzim)
Ứng dụng của ancol
Với những tính chất vật lý và hóa học kể trên, ancol sở hữu nhiều ứng dụng quan trọng trong công nghiệp thực phẩm (rượu, nước giải khát), y tế (dung môi, dược phẩm…), động cơ (nhiên liệu ô tô)…
.jpg)
Bài tập về ancol SGK Hóa học 11 kèm lời giải chi tiết
Cùng vận dụng những lý thuyết cơ bản trên để thực hành một số bài tập Hoá học cơ bản trong SGK Hóa học 11 về ancol sau đây!

Giải bài 1 trang 186 SGK Hóa 11
Viết công thức cấu tạo và gọi tên các ancol đồng phân có công thức phân tử C5H12O?
Gợi ý đáp án:
Công thức cấu tạo và gọi tên:
.jpg)
Giải bài 2 SGK Hóa 11 trang 186
Viết phương trình hóa học của phản ứng propan-1-ol với mỗi chất sau:
a. Natri kim loại.
b. CuO, đun nóng
c. Axit HBr, có xúc tác
Trong mỗi phản ứng trên ancol giữ vai trò gì: chất khử, chất oxi hoá, axit, bazơ? Giải thích.
Gợi ý đáp án:
a) 2CH3-CH2-CH2OH + 2Na → 2CH3-CH2-CH2ONa + H2↑
Ancol đóng vai trò chất oxi hóa
b) CH3-CH2-CH2OH + CuO → CH3-CH2-CHO + Cu + H2O
Ancol đóng vai trò chất khử
c) CH3-CH2-CH2OH + HBr → CH3-CH2-CH2Br + H2O
Ancol đóng vai trò bazơ
Giải bài 3 SGK trang 186 Hóa 11
Trình bày phương pháp hoá học để phân biệt các chất lỏng đựng trong các lọ không dán nhãn: etanol, glixerol, nước và benzen.
Gợi ý đáp án:
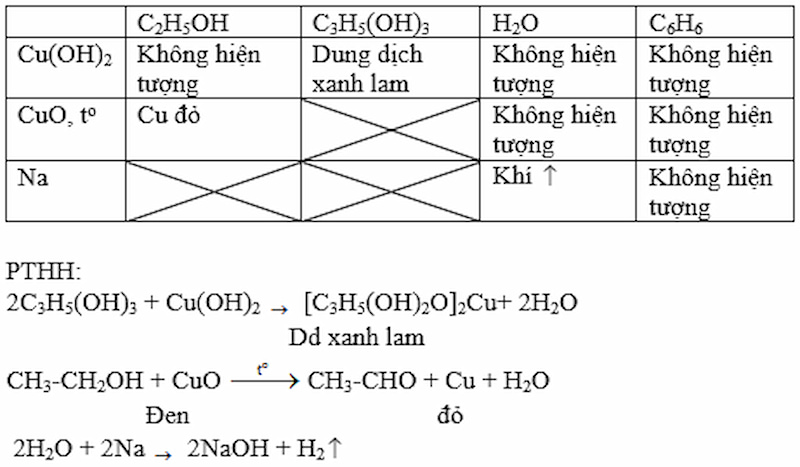
Giải bài 4 trang 186 Hóa 11 SGK
Từ propen và các chất vô cơ cần thiết có thể điều chế được các chất nào sau đây: propan-2-ol (1); propan-1,2-điol (2). Viết các phương trình hoá học của phản ứng xảy ra.
Gợi ý đáp án:
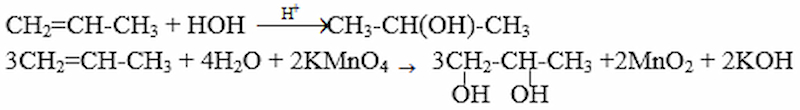
Giải bài 5 Hóa 11 SGK trang 187
Cho 12,20 gam hỗn hợp X gồm etanol và propan-1-ol tác dụng với Na (dư) thu được 2,80 lít khí đktc.
a. Tính thành phần phần trăm khối lượng của mỗi chất trong hỗn hợp X?
b. Cho hỗn hợp X qua ống đựng CuO, đun nóng. Viết các phương trình hoá học của phản ứng xảy ra.
Gợi ý đáp án:
a) Gọi số mol của etanol và propan-1-ol lần lượt là x và y (mol)
Phương trình phản ứng:

b) Phương trình phản ứng:
CH3-CH2OH + CuO → CH3-CHO + Cu + H2O (Điều kiện: Nhiệt độ)
CH3-CH2-CH2OH + CuO → CH3-CH2-CHO + Cu + H2O (Điều kiện: Nhiệt độ)
Trên đây là những kiến thức cơ bản và quan trọng nhất mà các bạn cần ghi nhớ khi tìm hiểu về ancol. Hy vọng bài viết này sẽ giúp bạn nắm chắc các thông tin về loại hợp chất hữu cơ phổ biến này, áp dụng một cách thành thạo vào các bài tập Hóa học cũng như thực tiễn đời sống. Chúc bạn có một quá trình học tập hiệu quả và đừng quên truy cập website của Wikihoc mỗi ngày để cập nhật thêm những bài học bổ ích.
