Thế nào là tinh thể nguyên tử, tinh thể phân tử? Tính chất chung của tinh thể nguyên tử và tinh thể phân tử là gì? Cùng tìm hiểu trong bài tổng hợp chi tiết dưới đây của Wikihoc!
Tinh thể nguyên tử là gì
Tinh thể nguyên tử cấu tạo từ những nguyên tử được sắp xếp một cách đều đặn theo một trật tự nhất định trong không gian tạo thành một mạng tinh thể. Ở các điểm nút của mạng tinh thể là những nguyên tử liên kết với nhau bằng các liên kết cộng hóa trị.
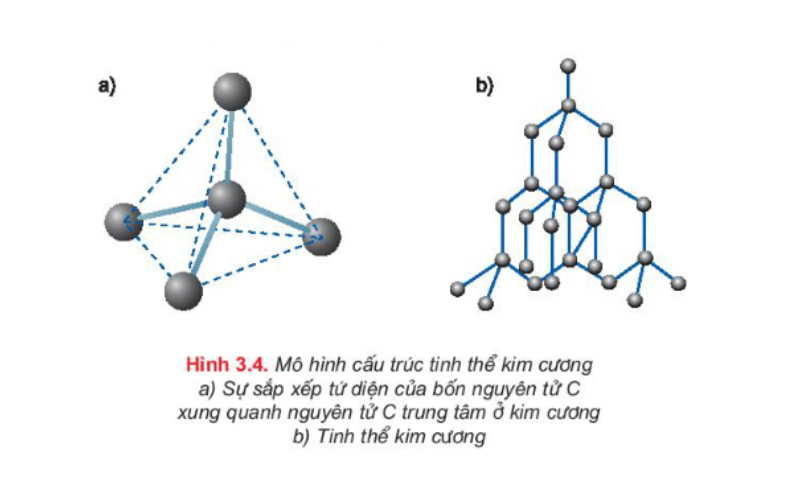
Ví dụ về tinh thể nguyên tử kim cương: Nguyên tử cacbon có 4 electron ngoài cùng. Trong tinh thể kim cương, mỗi nguyên tử cacbon liên kết với 4 nguyên tử cacbon lân cận gần nhất bằng 4 cặp electron chung, đó là liên kết cộng hóa trị. Các nguyên tử cacbon này nằm trên 4 đỉnh của một tứ diện đều.
Tính chất của tinh thể nguyên tử
Lực liên kết trong tinh thể nguyên tử rất lớn bởi vậy nó có những tính chất chung điển hình như:
-
Tính bền vững
-
Rất cứng
-
Nhiệt độ nóng chảy cao
-
Nhiệt độ sôi cao

Thực tế, kim cương có độ cứng lớn nhất so với các tinh thể đã biết nên được quy ước có độ cứng là 10 đơn vị. Đó là đơn vị để so sánh độ cứng của các chất.
Cách tính thể tích nguyên tử
Nguyên tử là những hạt vô cùng nhỏ và trung hòa về điện. Thành phần của nó bao gồm hạt nhân nguyên tử (proton và notron) và vỏ nguyên tử (electron).
Nguyên tử có dạng hình cầu có thể tích V = 4/3πr^3 (r là bán kính nguyên tử).
Tinh thể phân tử là gì?
Hẳn nhiều bạn học sẽ băn khoăn không biết tại sao nước lỏng thì linh động, nặng còn nước đá thì cứng và nhẹ hơn nước lỏng. Bài học về tinh thể phân tử cùng những tính chất của chúng sẽ giúp bạn giải đáp cụ thể câu hỏi này.
Tinh thể phân tử được cấu tạo từ những phân tử được sắp xếp một cách đều đặn theo một trật tự nhất định trong không gian, tạo thành một mạng tinh thể. Ở các điểm nút của mạng tinh thể là những phân tử liên kết với nhau bằng lực tương tác yếu giữa các phân tử.
Phần lớn các chất hữu cơ, các đơn chất phi kim ở nhiệt độ thấp đều kết tinh thành mạng lưới tinh thể phân tử (phân tử có thể gồm một nguyên tử bao gồm các khí hiếm hoặc nhiều nguyên tử như các halogen, O2, N2, H2, H2O, H2S, CO2…).
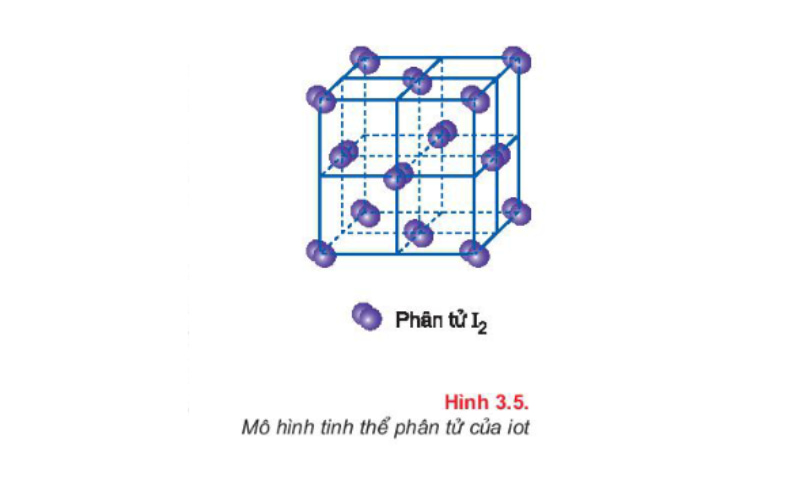
Ví dụ: Tinh thể iot (I2) là tinh thể phân tử.
Tính chất chung của tinh thể phân tử
Trong tinh thể phân tử, các phân tử vẫn tồn tại như những đơn vị độc lập và hút nhau bằng lực tương tác yếu giữa các phân tử. Vì vậy, tinh thể phân tử dễ nóng chảy, dễ bay hơi. Ngay ở nhiệt độ thường, một tinh thể như naphtalen (băng phiến) và iot đã bị phá hủy, các phân tử tách rời khỏi mạng tinh thể và khuếch tán vào không khí làm cho ta có thể dễ dàng nhận ra mùi của nó. Các tinh thể phân tử không phân cực dễ hòa tan vào trong các dung môi không phân cực như benzen, toluene, cacbon…
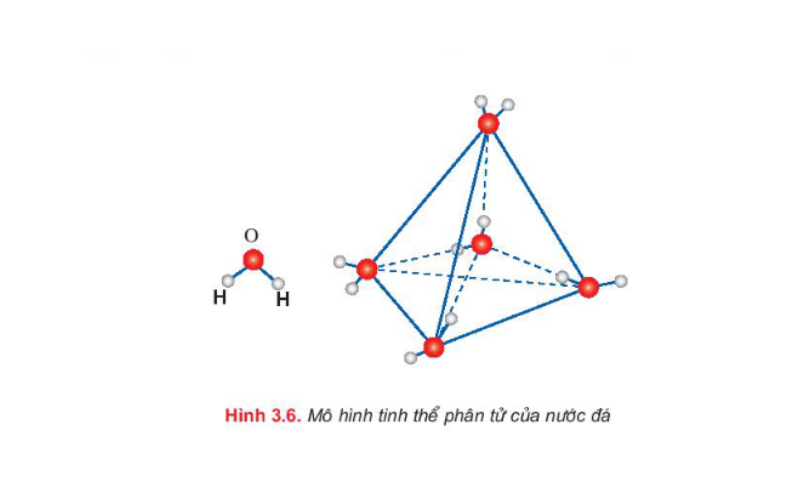
Quay trở lại câu hỏi về tinh thể phân tử của nước đá được đề cập ở trên, điều đó được giải thích như sau: Trong nước lỏng các phân tử nước chuyển động một một cách dễ dàng và gần nhau. Tuy nhiên, trong tinh thể phân tử nước đá, mỗi phân tử nước liên kết với 4 phân tử gần nhất nằm trên 4 đỉnh của một tứ diện đều.
Mỗi phân tử ở đỉnh lại liên kết với 4 phân tử khác nằm ở 4 đỉnh của hình tứ diện đều khác và cứ tiếp tục lặp lại như vậy. Cấu trúc tứ diện của tinh thể phân tử nước đá là cấu trúc rỗng nên nước đá có khối lượng riêng nhỏ hơn khối lượng riêng của nước lỏng. Trong tinh thể nước đá có liên kết hidro giữa các phân tử nước. Do cấu trúc tứ diện đều mà tinh thể phân tử nước đá cứng.
Xem thêm: Nhóm halogen là gì? Vị trí, đặc điểm, tính chất, cấu hình electron
Bài tập về tinh thể nguyên tử và tinh thể phân tử SGK hóa học 10 kèm lời giải
Qua những kiến thức lý thuyết về tinh thể nguyên tử, tinh thể phân tử và các tính chất chung của nó Wikihoc đã tổng hợp phía trên, bạn có thể bắt đầu làm các bài tập trong SGK để củng cố kiến thức.
Dưới đây là một vài bài tập và lời giải Wikihoc tổng hợp để bạn đọc tham khảo:

Bài tập 1 (SGK Hóa học 10 trang 70)
Tìm câu sai trong các câu sau:
A. Kim cương là một dạng thù hình của cacbon, thuộc loại tinh thể nguyên tử.
B. Trong mạng tinh thể nguyên tử, các nguyên tử được phân bố luân phiên đều đặn theo một trật tự nhất định.
C. Lực liên kết giữa các nguyên tử trong tinh thể nguyên tử là liên kết yếu.
D. Tinh thể nguyên tử bền vững, rất cứng, nhiệt độ nóng chảy và nhiệt độ sôi cao.
Gợi ý đáp án:
Đáp án sai là C (Lực liên kết giữa các nguyên tử trong tinh thể nguyên tử là liên kết yếu) vì thực tế lực liên kết giữa các nguyên tử trong tinh thể nguyên tử là rất lớn.
Bài tập 2 (SGK Hóa học 10 trang 70)
Tìm câu sai trong các câu sau đây:
A. Nước đá thuộc loại tinh thể phân tử.
B. Trong tinh thể phân tử, lực liên kết yếu giữa các phân tử là liên kết cộng hóa trị.
C. Trong tinh thể phân tử, lực liên kết giữa các phân tử là liên kết yếu.
D. Tinh thể iot là tinh thể phân tử.
Gợi ý đáp án:
Câu sai là câu B (Trong tinh thể phân tử, lực liên kết yếu giữa các phân tử là liên kết cộng hóa trị) vì thực tế trong tinh thể phân tử, các phân tử hút nhau bằng lực tương tác yếu giữa các phân tử.
Bài tập 3 (SGK Hóa học 10 trang 71)
Hãy kể tên các loại tinh thể đã học và tính chất chung của từng loại.
Gợi ý đáp án:
Có 3 loại tinh thể được học là tinh thể nguyên tử, tinh thể phân tử và tinh thể ion.
Tính chất chung của từng loại tinh thể như sau:
- Tinh thể nguyên tử: Bền vững, rất cứng, nhiệt độ nóng chảy và nhiệt độ sôi cao.
- Tinh thể phân tử: Dễ nóng chảy và dễ bay hơi.
- Tinh thể ion: Bền vững, khó bay hơi, khó nóng chảy.
Bài tập 4 (SGK Hóa học 10 trang 71)
a) Hãy đưa ra một số thí dụ chất có mạng tinh thể nguyên tử, chất có mạng tinh thể phân tử.
b) So sánh nhiệt độ nóng chảy của hai loại tinh thể nói trên. Giải thích?
Gợi ý đáp án:
a) Ví dụ chất có mạng tinh thể nguyên tử là kim cương. Ví dụ chất có mạng tinh thể phân tử ở nhiệt độ thấp thì có khí hiếm, O2, N2, … kết tinh thành tinh thể phân tử.
b) Nhiệt độ nóng chảy của tinh thể nguyên tử và tinh thể phân tử có tính chất trái ngược nhau. Tinh thể nguyên tử khó nóng chảy, khó bay hơi trong khi đó tinh thể phân tử lại dễ nóng chảy và dễ bay hơi.
Bài tập 5 (SGK Hóa học 10 trang 71)
Vì sao các hợp chất ion có nhiệt độ nóng chảy cao?
Gợi ý đáp án:
Các hợp chất ion có nhiệt độ nóng chảy cao là bởi lực hút tĩnh điện giữa các ion ngược dấu trong tinh thể rất lớn. Các hợp chất ion đều khá rắn, khó bay hơi và khó nóng chảy.
Trên đây là những thông tin tổng hợp chi tiết về tinh thể nguyên tử và tinh thể phân tử theo chuẩn SGK Hóa học (NXB Giáo dục Việt Nam) để bạn đọc tham khảo. Theo dõi chuyên mục Kiến thức cơ bản mỗi ngày để cập nhật thêm nhiều kiến thức mới hữu ích và thú vị từ Wikihoc bạn nhé! Chúc các bạn học tập tốt và đạt kết quả cao trong học tập!
