Từ thời xa xưa, con người đã biết sử dụng đồ dùng bằng sắt và hợp kim của sắt. Ngày nay cũng vậy, sắt vẫn là kim loại được ứng dụng rất nhiều trong cuộc sống hằng ngày. Điều này là do sắt có các tính chất vật lý và hóa học đặc biệt. Vậy kim loại sắt là gì? Khái niệm, tính chất và ứng dụng của sắt trong đời sống là gì? Hãy cùng Wikihoc tìm hiểu chi tiết trong nội dung sau đây!
Khái niệm kim loại sắt
Sắt là một nguyên tố hóa học trong bảng tuần hoàn với ký hiệu Fe, có số hiệu nguyên tử là 26, thuộc phân nhóm VIIIB và thuộc chu kỳ 4. Sắt có nhiều trên Trái Đất, được tạo thành từ các lớp vỏ và lõi Trái đất.
.jpg)
-
Kí hiệu: Fe.
-
Nguyên tử khối: 56.
-
Khối lượng riêng: 7.86 g / cm³.
-
Điểm nóng chảy là: 1539 ° C.
-
Khối lượng nguyên tử: 55,845u.
-
Số electron trên mỗi lớp vỏ lần lượt là: 2, 8, 14, 2.
-
Số nguyên tử: 26.
Tính chất vật lý của kim loại sắt
Sắt là loại kim loại có màu trắng xám, dẻo, dai, rất dễ rèn, nhiệt độ nóng chảy khá cao lên đến 1539 độ C. Sắt là chất dẫn nhiệt, dẫn điện tốt, có từ tính.
Tính chất hóa học của kim loại sắt
Sắt có những tính chất hóa học nào? Kim loại sắt có thể phản ứng với phi kim, axit, nước và muối để tạo thành hợp chất. Phản ứng hóa học của kim loại với các chất này có hoặc không có kèm theo chất xúc tác.

Tác dụng phi kim
Khi đun nóng, sắt phản ứng với hầu hết các phi kim.
Sắt phản ứng với oxi: 3Fe + 2O2 → Fe3O4
Fe3O4 là oxit sắt từ, là oxit của hỗn hợp sắt có hóa trị II và III: FeO và Fe2O3
Sắt phản ứng với phi kim khác: 2Fe + 3Cl2 → 2FeCl3
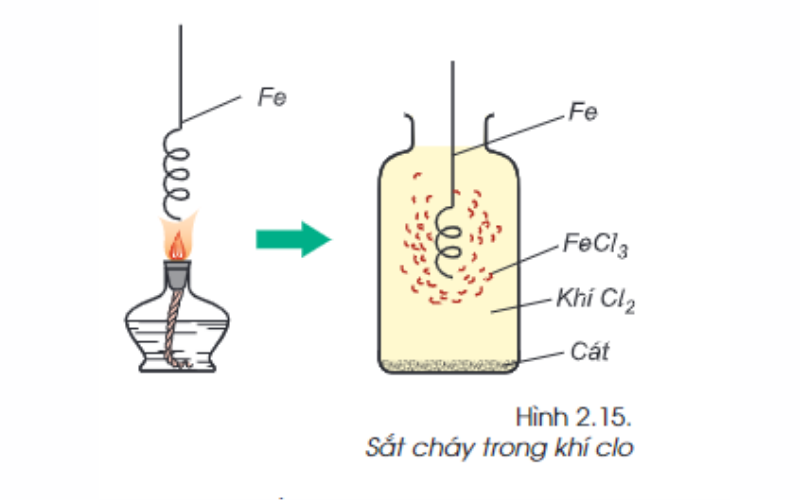
Ngoài oxi (O) và lưu huỳnh (S), sắt có thể phản ứng với nhiều phi kim loại khác như Cl2, Br2,… tạo thành muối.
Tác dụng với axit
Sắt phản ứng với HCl, H2S04 loãng tạo muối sắt (II) và giải phóng H2:
Fe + 2HCl (loãng) → FeCl2 + H2 ↑
Fe + 2H2SO4 (loãng) → FeSO4 + H2 ↑
Chú ý: Sắt (Fe) không phản ứng với axit HNO3 đặc, nguội và axit H2S04 đặc, nguội. Vì ở nhiệt độ thường, sắt tạo ra một lớp oxit bảo vệ kim loại không bị “thụ động hóa”, không bị hòa tan.
Sắt phản ứng với HNO3 đặc nóng, H2SO4 đặc nóng tạo thành muối sắt III:
2Fe + 6H2SO4 (đặc, nóng) → Fe2(SO4) 3 + 3SO2 + 6H2O
Fe + 6HNO3 (đặc, nóng) → Fe(NO3) 3 + 3NO2 + 3H2O
Tác dụng với dung dịch muối
Khi một kim loại sắt kết hợp với muối của một kim loại yếu hơn, phản ứng tạo ra một muối và kim loại mới.
Fe + CuSO4 → Cu + FeSO4
Tác dụng với nước
Khi kim loại sắt có thể phản ứng với nước, với điều kiện đun nóng ở nhiệt độ cao.
3Fe + 4H2O → Fe3O4 + 4H2 (< 5700C)
Fe + H2O → FeO + H2 (> 5700C)
Điều chế sắt như thế nào?
Sắt được điều chế bằng phương pháp nhiệt luyện. Dùng chất khử (CO, H2, Al, C) để khử các hợp chất của sắt.
Fe3O4 + 4CO → 3Fe + 4CO2 (điều kiện nhiệt độ)
Fe2O3 + 3H2 → 2Fe + 3H2O (điều kiện nhiệt độ)
Fe2O3 + 2Al → 2Fe + Al2O3 (điều kiện nhiệt độ)
Xem thêm:
- Hợp kim của sắt: Gang, thép là gì? Phân loại và cách sản xuất
- Nhôm là kim loại gì? Các tính chất, ứng dụng và cách sản xuất nhôm
Ứng dụng của kim loại sắt
Kim loại sắt có mặt trong hầu hết các lĩnh vực từ đồ dùng gia đình trong sinh hoạt đến sản xuất. Sắt được sử dụng rộng rãi trong các ngành công nghiệp như:
.jpg)
-
Đồ gia dụng: Bàn ghế, thùng rác, kệ sắt, móc treo đồ gia dụng như máy giặt, máy xay, máy cắt,…
-
Ngoại nội thất: Cầu thang, cửa sắt, cổng sắt, lan can, hàng rào sắt, tủ sắt, kệ sắt, phụ kiện cửa, trụ đèn,…
-
Ngành giao thông vận tải: Cầu vượt, đường ray xe lửa, cột đèn đường, khung của một số phương tiện giao thông,…
-
Ứng dụng trong ngành xây dựng: Giàn giáo sắt, chốt, trụ, lưới an toàn …
-
Ngành cơ khí: Phụ tùng máy móc thiết bị, phụ kiện cơ khí, bản lề cửa. Không những vậy sắt còn là một trong những vật liệu quan trong trong quá trình gia công cơ khí cho các sản phẩm chủ lực làm ra theo yêu cầu của khách hàng.
Bài tập về kim loại sắt Sách giáo khoa Hóa học 9 kèm lời giải
Sau khi đã hiểu rõ hơn về các lý thuyết về kim loại sắt thì bạn có thể thực hiện một số bài tập trong Sách giáo khoa Hóa học lớp 9 để nắm vững lại kiến thức đã học.

Bài tập 1 (SGK Hóa học 9, trang 60)
Sắt có những tính chất hoá học nào ? Viết các phương trình hoá học minh hoạ.
Gợi ý đáp án:
Sắt có những tính chất như sau:
- Tác dụng với phi kim
- Tác dụng với oxi tạo ra oxit sắt từ:
3Fe + 2O2 → (t0) Fe3O4
- Tác dụng với clo tạo thành sắt (III) clorua
2Fe + 3Cl2 → (t0) 2FeCl3
- Tác dụng với phi kim khác tạo thành muối.
- Tác dụng với dung dịch axit tạo thành muối sắt (II) và giải phóng khí H2
Fe + 2HCl → FeCl2 + H2↑
- Tác dụng với dung dịch muối
Sắt tác dụng với dung dịch muối của kim loại kém hoạt động hơn tạo thành muối mới và kim loại mới.
Fe + CuSO4 → FeSO4 + Cu
Bài tập 2 (SGK Hóa học 9, trang 60)
Từ sắt và các hoá chất cần thiết, hãy viết các phương trình hoá học để thu được các oxit riêng biệt: Fe3O4, Fe2O3 và ghi rõ điều kiện phản ứng, nếu có.
Gợi ý đáp án:
a) 3Fe + 2O2 → (t0) Fe3O4
b) 2Fe + 3Cl2 → (t0) 2FeCl3
FeCl3 + 3NaOH → 3NaCl + Fe(OH)3
2Fe(OH)3 → Fe203 + 3H2O
Bài tập 3 (SGK Hóa học 9, trang 60)
Có bột kim loại sắt lẫn tạp chất nhôm. Hãy nêu phương pháp làm sạch sắt.
Gợi ý đáp án:
Cho hỗn hợp bột kim loại vào dung dịch kiềm dư, nhôm sẽ bị hòa tan bởi kiềm
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Bài tập 4 (SGK Hóa học 9, trang 60)
Sắt tác dụng được với chất nào sau đây ?
a) Dung dịch muối Cu(NO3)2
b) H2SO4 đặc, nguội
c) Khí Cl2
d) Dung dịch ZnSO4.
Viết các phương trình hoá học và ghi điều kiện, nếu có.
Gợi ý đáp án:
Sắt tác dụng được với dung dịch Cu(NO3)2 và khí Cl2.
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
2Fe + 3Cl2 →(t0) 2FeCl3
Bài tập 5 (Trang 60 SGK)
Ngâm bột sắt dư trong 10 ml dung dịch đồng sunfat 1M. Sau khi phản ứng kết thúc, lọc được chất rắn A và dung dịch B.
a) Cho A tác dụng với dung dịch HCl dư. Tính khối lượng chất rắn còn lại sau phản ứng.
b) Tính thể tích dung dịch NaOH 1M vừa đủ để kết tủa hoàn toàn dung dịch B.
Gợi ý đáp án:
a) nCuSO4 = 1.0,01 = 0,01 mol
PTHH: Fe + CuSO4 → FeSO4 + Cu
Do sắt dư nên chất rắn A gồm: Cu và Fe dư
Cho A vào dung dịch HCl dư
Fe + 2HCl → FeCl2 + H2
=> Chất rắn còn lại là Cu : mCu = 0,01.64 = 0,64 gam
b) Dung dịch B gồm FeSO4
PTHH: FeSO4 + 2NaOH → Na2SO4 + Fe(OH)2
(mol) 0,01 0,02 0,01 0,01
Thể tích NaOH cần dùng là
VddNaOH = n/CM = 0,02/1= 0,02 lít = 20ml
Hy vọng bài viết đã giúp bạn hiểu rõ hơn về kim loại sắt và những ứng dụng của sắt trong đời sống. Đừng quên truy cập vào website Wikihoc mỗi ngày để đón đọc thêm nhiều kiến thức môn học khác nhé!
