Ankin là kiến thức quan trọng trong chương trình Hóa học lớp 11. Bài viết tổng hợp này sẽ giúp các bạn biết cách viết công thức cấu tạo, gọi tên một số ankin cũng như nắm được các tính chất và ứng dụng quan trọng của nó, đặc biệt là của axetilen.
Định nghĩa ankin là gì? Đồng đẳng, đồng phân, danh pháp
Trong hóa học hữu cơ, ankin là một hiđrocacbon không no mạch hở có chứa liên kết ba giữa các nguyên tử cacbon C≡C.
Dãy đồng đẳng ankin
Ta có công thức chung của ankin như sau: CnH2n-2 (n >= 2).
Cấu tạo của phân tử axetilen được biểu diễn như hình bên dưới.
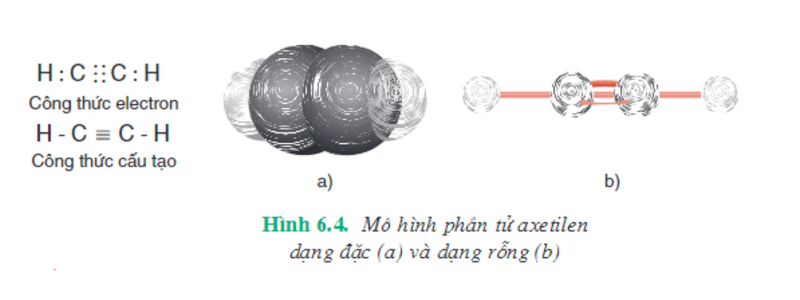
Đồng phân
Hai chất đầu dãy (C2H2, C3H4) không có đồng phân ankin. Các ankin từ C4H6 trở lên có đồng phân vị trí của liên kết ba, từ C5H8 còn có đồng phân mạch cacbon tương tự anken.
Danh pháp ankin
Tìm hiểu danh pháp của ankin ta sẽ biết cách gọi tên thông thường và tên thay thế của nó.
– Gọi tên ankin thông thường
Tên thông thường của dãy đồng đẳng ankin được gọi như sau:
Tên thông thường = Tên gốc ankyl liên kết với nguyên tử C của liên kết ba + axetilen.
Các gốc ankyl được gọi theo thứ tự chữ cái đầu tên gọi của chúng.
Ví dụ về các tên thông thường của ankin:
HC≡CH: Axetilen.
CH≡C-CH2-CH3: Etylaxetilen.
CH3-C≡C-CH3: Đimetylaxetilen.
CH3-CH2-CH2-C≡CH: Propylaxetilen.
– Cách gọi tên ankin thay thế
Tên thay thế của ankin được xuất phát từ tên của ankan có cùng mạch cacbon bằng cách thay đổi đuôi “an” thành “in”.
Từ C4H6 trở đi, chúng ta chỉ cần thêm số chỉ vị trí nguyên tử cacbon bắt đầu liên kết ba. Mạch cacbon được đánh số từ phía gần liên kết ba hơn.
Các ankin có liên kết ba ở đầu mạch (dạng R-C≡CH) được gọi là các ank-1-in. Etin còn có tên thông thường là axetilen.
Dưới đây là bảng tên thay thế và một vài hằng số vật lý của một số ankin.
.jpg)
Tính chất vật lý của ankin
Tìm hiểu về ankin không thể không nhắc tới các tính chất vật lý quan trọng của nó như:

-
Các ankin có nhiệt độ sôi tăng dần theo chiều tăng của phân tử khối.
-
Các ankin có nhiệt độ sôi cao hơn và khối lượng riêng lớn hơn các anken tương ứng.
-
Giống ankan và anken, các ankin cũng không tan trong nước và nhẹ hơn nước.
3 tính chất hóa học của ankin
Liên kết ba trong phân tử ankin gồm một liên kết σ bền và hai liên kết π kém bền hơn. Do đó, các ankin dễ dàng tham gia vào phản ứng cộng. Không chỉ vậy, ankin-1-in còn có phản ứng thế nguyên tử H liên kết với nguyên tử C của liên kết ba bằng nguyên tử kim loại.

Phản ứng cộng
Tùy từng điều kiện phản ứng mà ankin tham gia phản ứng cộng với một hoặc hai phân tử tác nhân tạo thành hợp chất không no loại anken hoặc hợp chất no.
Phản ứng cộng hidro
Khi có niken (hoặc platin/ palađi) làm chất xúc tác, ankin cộng hidro tạo thành anken, sau đó tạo thành ankan.
Ví dụ:
CH≡CH + H2 → CH2=CH2 (Điều kiện: Ni, nhiệt độ).
CH2=CH2 + H2 → CH3-CH3 (Điều kiện: Ni, nhiệt độ).
Khi dùng chất xúc tác là hỗn hợp Pd/ PbCO3 hoặc Pd/ BaSO4 thì ankin chỉ cộng một phân tử hidro thành anken. Đây chính là đặc tính để điều chế anken từ ankin.
Ví dụ như:
CH≡CH + H2 → CH2=CH2 (Điều kiện: Pd/ PbCO3, nhiệt độ).
Phản ứng cộng brom, clo của ankin
Brom và clo cũng tác dụng với ankin theo hai giai đoạn liên tiếp.
Ví dụ: CH≡CH + Br2 (dd) → CHBr=CHBr (1,2-ddibrometten)
CHBr≡CHBr + Br2 (dd) → CHBr2-CHBr2 (1,1,2,2-tetrabrometan)
Phản ứng cộng HX của ankin (X là OH, Cl, Br, CH3COO…)
Ankin tác dụng với HX theo 2 giai đoạn liên tiếp:
Ví dụ:
CH≡CH + HCl → CH2=CHCl (Điều kiện: Nhiệt độ, xt)
CH2=CHCl + HCl → CH3-CHCl2 (Nhiệt độ, xt).
Khi có xúc tác thích hợp thì ankin tác dụng với HCl sinh ra dẫn xuất monoclo của anken.
Ví dụ:
CH≡CH + HCl → CH2=CHCl (vinyl clorua) (Điều kiện: HgCl2; 150 -200 độ C).
Phản ứng cộng HX của các ankin cũng tuân theo quy tắc Mac-côp-nhi-côp.
Ví dụ:
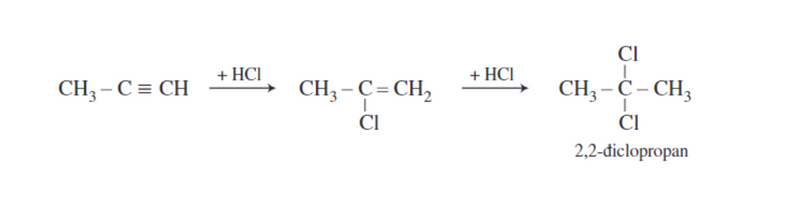
Phản ứng cộng H2O của các ankin chỉ xảy ra theo tỷ lệ số mol 1:1.
Ví dụ:
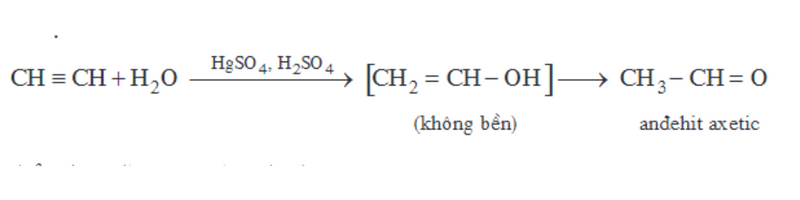
Phản ứng đime và trime hóa
Hai phân tử axetilen cộng hợp với nhau tạo thành vinylaxetilen:
2CH≡CH → CH≡C-CH=CH2 (Điều kiện: Nhiệt độ, xt)
Ba phân tử axetilen cộng hợp với nhau tạo thành benzen. Về hình thức, đây cũng là phản ứng cộng HX vào liên kết ba, với HX là H-C≡CH
Phản ứng thế bằng ion kim loại
Thực hiện thí nghiệm sục khí axetilen vào dung dịch bạc nitrat trong amoniac, thấy có kết tủa vàng nhạt. Đó chính là muối bạc axetilua tạo thành do phản ứng:
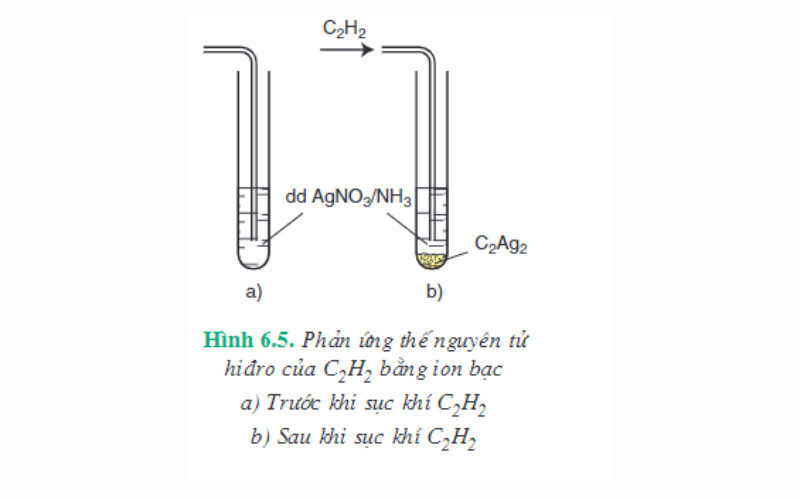
CH≡CH + 2AgNO3 + 2NH3 → Ag-C≡C-Ag (bạc axetilua kết tủa) + 2NH4NO3
Dựa vào phản ứng này ta có thể nhận xét rằng, nguyên tử hidro có khả năng liên kết trực tiếp với nguyên tử liên kết ba đầu mạch có tính linh động cao hơn các nguyên tử hidro khác nên có thể bị thay thế bằng ion kim loại.
Các ank-1-in khác như propin, but-1-in… cũng có phản ứng tương tự axetilen. Bởi vậy tính chất này sẽ được sử dụng để phân biệt ank-1-in với anken và các ankin khác.
Phản ứng oxi hóa
Ankin tham gia phản ứng oxi hóa hoàn toàn và phản ứng oxi hóa không hoàn toàn.
Phản ứng oxi hóa hoàn toàn
Các ankin cháy tỏa nhiều nhiệt:
2CnH2n-2 + (3n-1)O2 → 2nCO2 + 2(n-1)H2O (Điều kiện: Nhiệt độ)
Ví dụ: 2C2H2 + 5O2 → 4CO2 + 2H2O
Phản ứng oxi hóa không hoàn toàn
Tương tự như anken và ankađien, ankin cũng có khả năng làm mất màu dung dịch thuốc tím.
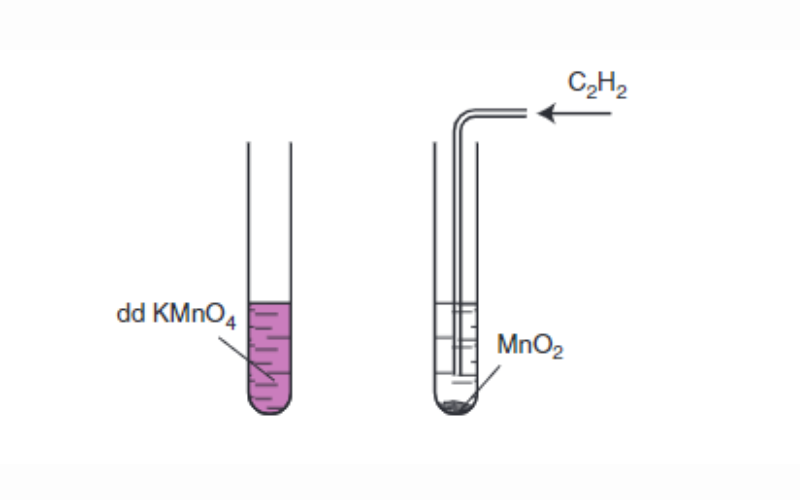
Cách điều chế ankin
Điều chế ankin trong phòng thí nghiệm và sản xuất trong công nghiệp sẽ có những cách thực hiện khác nhau.
Trong phòng thí nghiệm
Trong phòng thí nghiệm và trong công nghiệp trước đây thì axetilen được điều chế bằng cách cho canxi cacbua (CaC2) tác dụng với nước. Ta có phương trình phản ứng như sau:
CaC2 + 2H2O → C2H2 + Ca(OH)2
Trong công nghiệp
Ngày nay, trong công nghiệp axetilen được sản xuất chủ yếu từ metan:
2CH4 → C2H2 + 3H2 (Điều kiện: 1500 độ C)
2 ứng dụng quan trọng của ankin
Ứng dụng ankin quan trọng trong đời sống là làm nhiên liệu và làm nguyên liệu.
.jpg)
Ứng dụng của ankin trong làm nhiên liệu
Khi cháy, axetilen tỏa nhiều nhiệt nên nó được sử dụng trong đèn xì oxi axetilen để hàn, cắt kim loại.
Ứng dụng của ankin trong làm nguyên liệu
Từ axetilen chúng ta có thể điều chế được nhiều chất đầu quan trọng cho các quá trình tổng hợp hữu cơ.
Bài tập về ankin SGK Hóa học 11 kèm lời giải
Dựa vào những kiến thức lý thuyết Wikihoc tổng hợp ở trên, bạn hãy bắt tay vào làm bài tập về ankin để ôn tập bài học và biết cách vận dụng kiến thức tốt nhất nhé! Dưới đây là các bài tập cơ bản trong SGK Hóa học 11 kèm gợi ý đáp án để bạn tham khảo.

Bài 2 (SGK Hóa học 11, trang 145)
Viết phương trình hóa học của phản ứng giữa propin và các chất sau:
a) hidro có xúc tác Pd/PbCO3
b) dung dịch brom (dư)
c) dung dịch bạc nitrat trong amoniac
d) hidro clorua có xúc tác HgCl2
Gợi ý đáp án:
a) CH ≡ C – CH3 + H2 -Pb/PbCO3, to→ CH2 = CH – CH3
b) CH ≡ C – CH3 + 2Br2 → CHBr2 – CBr2 – CH3 dd(dư)
c) CH ≡ C – CH3 + AgNO3 + NH3 → AgC ≡ C – CH3 + NH4NO3
d) CH ≡ C – CH3 + HCl -HgCl2→ CH2 = CCl – CH3
Bài 3 (SGK Hóa học 11, trang 145)
Trình bày phương pháp hóa học:
a) Phân biệt axetilen với etilen
b) Phân biệt ba bình không dán nhãn chứa mỗi khí không màu sau: metan, etilen, axetilen
Gợi ý đáp án:
a) Cho tác dụng với dung dịch AgNO3 trong NH3 dư, chất nào tạo kết tủa thì đó là axetilen, chất nào không tạo kết tủa thì là etilen.
Phương trình phản ứng:
CH ≡CH + 2AgNO3 + 2NH3 → AgC≡CAg↓ +2NH4NO3
b) Lấy từ 3 bình các mẫu nhỏ để phân biệt.
Lần lượt dẫn các mẫu khí qua dung dịch AgNO3/NH3, mẫu nào làm dung dịch xuất hiện kết tủa thì đó là axetilen
CH ≡CH + 2AgNO3 + 2NH3 → AgC≡CAg↓ +2NH4NO3
Lần lượt dẫn 2 mẫu khí còn lại qua dung dịch brom, mẫu khí nào làm nhạt màu nước brom là etilen.
CH2=CH2 + Br2 → BrCH2=CH2Br
Mẫu còn lại là metan.
Bài 4 (SGK Hóa học 11, trang 145)
Cho các chất sau: metan,etilen, but-2-in và axetilen. Kết luận nào sau đây là đúng?
A. Cả 4 chất đều có khả năng làm mất màu dung dịch brom
B. Có 2 chất tạo kết tủa với dung dịch bạc nitrat trong amoniac
C. Có ba chất có khả năng làm mất màu dung dịch Brom
D. Không có chất nào làm nhạt màu dung dịch kali pemanganat
Gợi ý đáp án:
Kết luận đúng là C: Có ba chất có khả năng làm mất màu dung dịch Brom
Phương trình hóa học:
CH2=CH2 +Br2→ CH2Br-CH2Br
CH3-C≡C-CH3 + 2Br2 → CH3-CBr2-CBr2 –CH3
CH≡CH + 2Br2→ CHBr2 -CHBr2
Bài 5 (SGK Hóa học 11, trang 145)
Dẫn 3,36 lít khí hỗn hợp A gồm propin và etilen đi vào một lượng dư dung dịch AgNO3 trong NH3 thấy còn 0,840 lít khí thoát ra và có m gam kết tủa. Các thể tích khí đo ở đktc.
a) Tính phần trăm thể tích etilen trong A
b) Tính m
Gợi ý đáp án:
a) Khi dẫn hỗn hợp A đi qua dung dịch AgNO3/NH3 (dư) thì propin sẽ tác dụng hết với AgNO3/NH3, etilen không tác dụng.
Vậy 0,840 lít khí thoát ra là etilen.
b) Thể tích proprin là: 3,36 – 0,84 = 2,52 (l)
nC3H4 = 2,52/ 22,4 = 0,1125 (mol)
Ta có PT:
CH≡C-CH3 + AgNO3 + NH3 → AgC≡C-CH3↓ + NH4NO3
⇒ m = 0,1125 x 147 = 16,5375 (g)
Bài tập Ankin tự luyện
Ngoài những bài tập trong sách giáo khoa, dưới đây là một số bài tập liên quan khác để các em cùng nhau luyện tập:
Câu 1: Đốt cháy hoàn toàn hỗn hợp M gồm một ankan X và một ankin Y, thu được số mol CO2 bằng số mol H2O. Thành phần phần trăm về số mol của X và Y trong hỗn hợp M lần lượt là
A. 75% và 25%.
B. 20% và 80%.
C. 50% và 50%.
D. 80% và 20%.
Câu 2: Đốt cháy hoàn toàn hỗn hợp X gồm 2 ankin có tỉ lệ mol 1:1 thì thu được 15,68 lít CO2 (đktc) và 9,0 gam H2O. Công thức của 2 ankin là
A.C4H6 và C5H8
B.C2H2 và C3H4
C.C3H4 và C5H8
D.C3H4 và C4H6
Câu 3: Đốt cháy hoàn toàn m gam ankin X thu được m gam nước. Công thức phân tử của X là
A. C3H4
B. C5H8
C. C3H4
D. C4H6
Câu 4: Đốt cháy hoàn toàn 1 lít hỗn hợp khí gồm C2H2 và hiđrocacbon A sinh ra 2 lít khí CO2 và 2 lít H2O (các thể tích khí và hơi đo ở cùng điều kiện về nhiệt độ và áp suất). Công thức phân tử của A là
A. C2H6
B. CH4
C. C2H4
D. C3H8
Câu 5: Hỗn hợp X có tỉ khối so với H2 là 21,2 gồm propan, propen và propin. Khi đốt cháy hoàn toàn 0,1 mol X, tổng khối lượng của CO2 và H2O thu được là
A. 20,40 gam.
B. 18,60 gam.
C. 16,80 gam.
D. 18,96 gam.
Câu 6: Hỗn hợp khí X gồm etilen, metan, propin và vinylaxetilen có tỉ khối với H2 là 17. Đốt cháy hoàn toàn 0,05 mol hỗn hợp X rồi hấp thụ toàn bộ sản phẩm cháy vào bình đựng Ca(OH)2 dư thì khối lượng bình tăng thêm m gam. Giá trị m là
A. 7,3.
B. 3,39.
C. 6,6.
D. 5,85.
Câu 7: Một hợp chất gồm 2 ankin khi đốt cháy cho ra 13,2 gam CO2 và 3,6 gam H2O. Khối lượng brom có thể cộng vào hỗn hợp trên là
A. 16 gam.
B. 24 gam.
C. 32 gam.
D. 36 gam.
Câu 8: Hỗn hợp X có tỷ khối so với H2 là 13,7 gồm etan, eten, etin. Đốt cháy hoàn toàn 0,1 mol X , toàn bộ sản phẩm cháy cho qua bình đựng dung dịch H2SO4 đặc thấy khối lượng bình tăng m (g) . Xác định m?
A. 3,6 g
B. 2,04 g
C. 3,06 g
D. 5,3 g
Câu 9: Hỗn hợp X gồm 0,1 mol C2H2 ; 0,15 mol C2H4; 0,2 mol C2H6 và 0,3 mol H2. Đun nóng hỗn hợp X với Ni, xúc tác một thời gian thu được hỗn hợp Y. Đốt cháy hoàn toàn Y thu được số gam CO2 và H2O lần lượt là:
A. 23,4 g và 39,4 g
B. 39,6 g và 23,4 g
C. 19,8 g và 11,7 g
D. 11,7 g và 19,8 g
Câu 10: Đốt cháy m gam hỗn hợp C2H6, C3H4, C3H8, C4H10 được 35,2 gam CO2 và 21,6 gam H2O. Giá trị của m là
A. 14,4.
B. 10,8.
C. 12.
D. 56,8.
Trên đây là toàn bộ kiến thức tổng hợp về ankin để bạn đọc tham khảo. Chúc các bạn ôn tập thật tốt và đừng quên ghé đọc website Wikihoc.edu.vn mỗi ngày để tìm đọc thêm nhiều bài viết chia sẻ kiến thức hữu ích các môn Toán, Vật lý, Tiếng Anh… khác nữa nhé!
